
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
|
| A. | 1.0mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO42﹣ |
|
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2﹣、Cl﹣ |
|
| C. | c(H+)=10﹣12mol•L﹣1的溶液:K+、Ba2+、Cl﹣、Br﹣ |
|
| D. | 加入苯酚显紫色的溶液:K+、NH4+、Cl﹣、I﹣ |
| 离子共存问题.. | |
| 专题: | 离子反应专题. |
| 分析: | A.酸性条件下NO3﹣具有强氧化性,具有还原性的离子不能大量共存; B.甲基橙呈红色的溶液呈酸性; C.c(H+)=10﹣12 mol•L﹣1的溶液呈碱性; D.加入苯酚显紫色的溶液,含有Fe3+,与Fe3+反应的离子不能大量共存. |
| 解答: | 解:A.酸性条件下NO3﹣具有强氧化性,具有还原性的Fe2+不能大量共存,故A错误; B.甲基橙呈红色的溶液呈酸性,酸性条件下AlO2﹣不能大量共存,且AlO2﹣与NH4+发生互促水解反应而不能大量共存,故B错误; C.c(H+)=10﹣12 mol•L﹣1的溶液呈碱性,碱性条件下,离子之间不发生任何反应,可大量共存,故C正确; D.加入苯酚显紫色的溶液,含有Fe3+,I﹣与Fe3+发生氧化还原反应而不能大量共存,故D错误. 故选C. |
| 点评: | 本题考查离子共存问题,为高考高频考点和常见题型,侧重于学生的分析能力、审题能力的考查,注意把握常见离子的性质以及反应类型的判断,把握题给信息,难度不大. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
500 mL 2 mol/L FeCl3溶液和500 mL 2 mol/L明矾溶液分别滴入沸水中,加热制成甲、乙两种分散系,经测定甲分散系中分散质的粒子大小在1~100 nm之间, 乙分散系中分散质的粒子大小在10-9~10-7 m之间。下列关于甲、乙分散系的判断合理的是( )
乙分散系中分散质的粒子大小在10-9~10-7 m之间。下列关于甲、乙分散系的判断合理的是( )
A.在暗室里用一束明亮的“强光”照射甲、乙两种分散系,发现甲有丁达尔效应,乙没有丁 达尔效应
达尔效应
B.向甲、乙两种分散系中分别滴加过量的氢氧化钠溶液,现象都是“先聚沉,后溶 解”
解”
C.蒸干、灼烧FeCl3和明矾溶液会得到对应的固体盐
D.向甲、乙两种分散系中分别滴加过量氢碘酸溶液,现象分别是深褐色溶液、无色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
关于物质分类的正确组合是( )
| 组合分类 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 纯碱 | 盐酸 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | 烧碱 | 硫酸 | 食盐 | 氧化镁 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 碳酸铵 | 过氧化钠 | 二氧化硫 |
| D | 苛性钾 | 盐酸 | 小苏打 | 氧化钠 | 三氧化硫 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列热化学方程式
(1)C(s)+O2(g)═CO2 (g)△H1=﹣393.5kJ/mol
(2)H2(g)+O2(g)═H2O(l)△H2=﹣285.8kJ/mol
(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=﹣870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
|
| A. | △H=﹣488.3 kJ/mol | B. | △H=+244.1 kJ/mol |
|
| C. | △H=﹣996.6 kJ/mol | D. | △H=+996.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
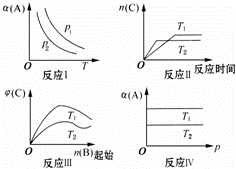
某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)⇌cC(g)表示]化学平衡的影响,得到如图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):
分析图象,回答下列问题:
(1)在图象反应Ⅰ中,若p1>p2,则此正反应为 (填“吸热”或“放热”)反应,也是一个气体分子数 (填“减少”或“增大”)的反应,由此判断,此反应自发进行,必须满足的条件是 .
(2)在图象反应Ⅱ中,T1 < T2(填“>”、“<”或“=”),该正反应为 (填“吸热”或“放热”)反应.
(3)在图象反应Ⅲ中,若T2>T1,则此正反应为 (填“吸热”或“放热”)反应.
(4)在图象反应Ⅳ中,若T1>T2,则该反应能否自发进行?
查看答案和解析>>
科目:高中化学 来源: 题型:
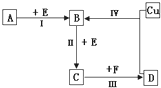
有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
(1)若A、B、C、D均为含X元素的化合物,且A、F的一个分子中都只含有10个电子,则:
①A分子的空间构型为 三角锥形 ,F分子的电子式为 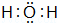 .
.
②反应 I 的化学方程式为 4NH3+5O2 4NO+6H2O .
4NO+6H2O .
③化合物NaX3是合成“达菲”的中间活性物质,也是汽车安全气囊中的主要物质.NaX3受撞击后生成Na3X和另一种气体单质,请写出该反应的化学方程式 3NaN3=Na3N+4N2↑ .
④X的氧化物是形成光化学烟雾原因之一,工业上可采用它与其氢化物反应生成无毒害物质而除去,请用方程式表示该反应 6NOx+4xNH3=(3+2x)N2+6xH2O .
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为120g•mol﹣1,则:
①将反应IV所得的溶液加热蒸干得到的晶体属于 离子 晶体(填“离子”、“分子”、“原子”)
②反应 I 的化学方程式为 4FeS2+11O2 2Fe2O3+8SO2 .
2Fe2O3+8SO2 .
③含Y元素的化合物Na2Y和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,请写出该反应的离子反应方程式 S2﹣+4ClO﹣=SO42﹣+4Cl﹣ .
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应N2(g)+3H2(g)⇌2NH3(g)+Q;Q>0,下列研究目的和示意图相符的是 ( )
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
|
|
|
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO 、SO
、SO 中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+)>0.1mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+)>0.1mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
A.甲溶液含有Ba2+ B.乙溶液含有SO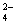
C.丙溶液含有Cl- D.丁溶液哈有Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com