
| A、1 L 1mol?L-1CaCl2溶液中含有的氯离子数为2NA |
| B、锌从盐酸中置换出1 mol H2,电子转移数为NA |
| C、常温常压下,11.2 L氧气含有的原子数为NA |
| D、4.4 g二氧化碳含有的原子数为0.1NA |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验剩余的药品不能放回原试剂瓶 |
| B、可燃性气体点燃前进行验纯 |
| C、实验结束后将试管清洗干净 |
| D、胶头滴管不能交叉使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
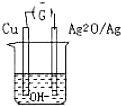 普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )| A、工业上以黏土、石灰石为主要原料来制造水泥 |
| B、测量原理示意图中 Ag2O为负极 |
| C、负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O |
| D、电池工作时OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝和稀盐酸反应:Al+2H+=Al3++H2↑ | ||
B、稀硝酸和碳酸钙反应:2H++CO
| ||
C、氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO
| ||
| D、用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com