
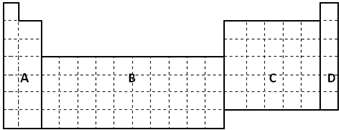
分析 (1)过渡元素均为金属元素;
(2)有机物大都含有氢元素,非金属的氢化物中含有氢元素,H元素能与大多数的非金属元素形成化合物;
(3)甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,则甲为Al,乙元素原子核外M电子层与K电子层上的电子数相等,则乙为Mg;
①Al位于周期表中第三周期ⅢA族;
②同周期自左而右元素金属性减弱,可以根据金属与水的反应难易、剧烈程度或金属和酸反应置换出氢气的难易或是最高价氧化物对应水化物的碱性强弱或金属单质之间的置换反应等来判断.
解答 解:(1)A区中H元素为非金属性,B区为过渡元素,全部为金属元素,C区中含有金属与非金属元素,D区为稀有气体,
故答案为:(b);
(2)有机物大都含有氢元素,非金属的氢化物中含有氢元素,H元素能与大多数的非金属元素形成化合物,
形成化合物最多的元素可能是H元素,
故答案为:H;
(3)甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,则甲为Al,乙元素原子核外M电子层与K电子层上的电子数相等,则乙为Mg;
①Al位于第三周期ⅢA族,核外电子排布式为1s22s22p63s23p1,
故答案为:1s22s22p63s23p1;
②同周期自左而右元素金属性减弱,故金属性Mg>Al,
(a) 金属在在空气中放置已久,表面生成氧化物保护膜,阻止金属与水反应,不能比较金属性强弱,故错误;
(b) 将除掉表面氧化膜的这两种元素的单质分别和同浓度的盐酸反应,反应越剧烈,则元素金属性越强,故正确;
(c) 将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液,比较碱性强弱,加入Mg粉的溶液呈浅红色,而加入Al粉的无明显现象,故正确;
(d) 二者都是金属元素,不能比较氢化物的稳定性判断金属性强弱,故错误,
故答案为:Mg;bc.
点评 本题考查元素周期表与元素周期律,难度不大,注意掌握金属性、非金属性强弱比较与实验事实.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
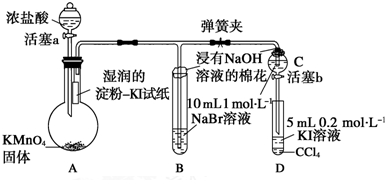
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1=-178.32kJ•mol-1△H2=-78.3kJ•mol-1 | |
| B. | △H1=178.32kJ•mol-1△H2=-78.3kJ•mol-1 | |
| C. | △H1=-178.32kJ•mol-1△H2=78.3kJ•mol-1 | |
| D. | △H1=178.32kJ•mol-1△H2=78.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上层为紫色液体,下层为无色液体 | B. | 上层为无色液体,下层为紫色液体 | ||
| C. | 均为紫色液体 | D. | 上层为橙色液体,下层为无色液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
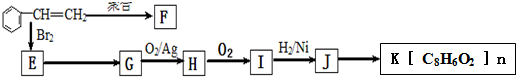
 ;J的分子式是C8H8O3.
;J的分子式是C8H8O3.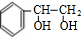 +O2$→_{△}^{Ag}$
+O2$→_{△}^{Ag}$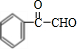 +2H2O;反应类型属于氧化反应
+2H2O;反应类型属于氧化反应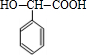 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$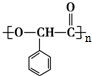 +n H2O
+n H2O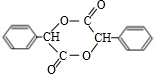 .
.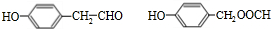 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com