
 能源是当今社会发展的三大支柱之一,有专家指出:如果对燃料产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化( )
能源是当今社会发展的三大支柱之一,有专家指出:如果对燃料产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化( )| A. | 化学能 | B. | 热能 | C. | 生物能 | D. | 电能 |
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 不慎把浓硫酸粘在手上,立即用大量的水冲洗,涂上3%-5%的碳酸氢钠溶液 | |
| B. | 如果汽油、煤油等可燃物着火,应立即用沙土扑灭 | |
| C. | 不慎将浓碱沾到皮肤上,立即用大量的水冲洗,然后涂上硼酸溶液 | |
| D. | 酒精灯不慎碰翻着火,应立即用湿布盖灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
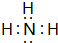 ,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 序号 | 平衡移动的因素(填序号) | 平衡移动的方向(填序号) |
| A | ||
| B | ||
| C | ||
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
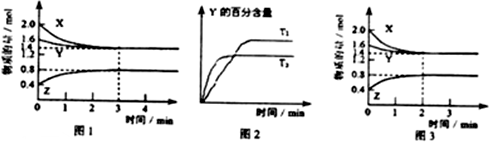
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
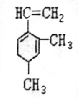 己知某有机物的结构简式如图,它是具有环状结构的不饱和烃.
己知某有机物的结构简式如图,它是具有环状结构的不饱和烃.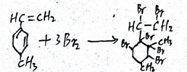 ;
;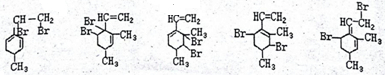 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液:Fe2+、Br-、Na+、NO3- | |
| B. | 由水电离产生的c(H+)=1.0×10-12mol•L-1的溶液中:K+、AlO2-、NO3-、Na+ | |
| C. | 中性溶液中:Fe3+、K+、Al3+、SO42- | |
| D. | 在0.1 mol•L-1Na2CO3溶液中:A1O2-、Na+、NO3-、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去Fe2O3、Al2O3混合物中的Fe2O3加NaOH溶液 | |
| B. | 除去Na2O2中的Na2O,加热 | |
| C. | 除去Na2CO3固体中的NaHCO3,加NaOH固体 | |
| D. | 除去Fe、C合金中的C,在O2中灼烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com