
分析 应中S元素化合价由Na2SO3中+4价升高为+6价,总共升高2价,I元素化合价由KIO3中+5降低为I2中0价,总共降低10价,化合价最小公倍数为10,故Na2SO3系数为5,故I2系数为1,再结合原子守恒配平;
(1)I元素化合价由KIO3中+5降低为I2中0价,每生成1molI2转移10mol电子,据此计算生成碘的物质的量,再根据m=nM计算质量;
(2)由慢反应决定整个反应过程的速率;
(3)由反应④可知,SO32-的还原性大于I-,可被I2氧化,据此解答.
解答 解:反应中S元素化合价由Na2SO3中+4价升高为+6价,总共升高2价,I元素化合价由KIO3中+5降低为I2中0价,总共降低10价,化合价最小公倍数为10,故Na2SO3系数为5,故I2系数为1,再结合原子守恒配平后方程式为5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O;
(1)I元素化合价由KIO3中+5降低为I2中0价,每生成1molI2转移10mol电子,故反应中有5mol电子转移,生成的碘的物质的量为$\frac{5mol}{10mol}$×1mol=0.5mol,故答案为:0.5;
(2)由慢反应决定整个反应过程的速率,故反应速率由①步反应决定,故答案为:①;
(3)由反应④可知,SO32-的还原性大于I-,可被I2氧化,故需消耗完SO32-,才会生成I2,才会有溶液变蓝的现象产生,
故答案为:SO32-.
点评 本题考查氧化还原反应的配平与计算等,难度中等,注意反应中电子的转移数目的计算,比较容易.


科目:高中化学 来源: 题型:选择题
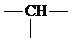 .则它的可能结构有( )
.则它的可能结构有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯(C2H4)的电子式: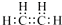 | B. | 丙烯(C3H6)的结构简式:CH2CHCH3 | ||
| C. | 立方烷(C8H8)的键线式: | D. | 溴乙烷(C2H5Br)的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

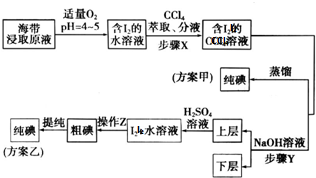
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测稀碱溶液的pH,测定值偏小 | |
| B. | 容量瓶中含有少量蒸馏水对所配制的溶液无影响 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| D. | 测定中和反应的中和热时,保温效果越好,测定误差越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | Ka(CH3COOH) | C. | c(H+)•c(OH-) | D. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、I2、HI的浓度相等 | B. | 混合气体的颜色不再改变 | ||
| C. | H2、I2、HI的浓度之比为1:1:2 | D. | 混合气体的平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IA族的所有元素都是金属元素 | |
| B. | 同周期主族元素中,第ⅦA族元素原子半径最小 | |
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| D. | -般在元素周期表的金属与非金属分界线附近寻找一些化学反应新型催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com