
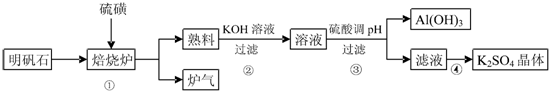
分析 根据题中工业流程可知,明矾石与硫在加热的条件下生成二氧化硫和氧化铝,所以炉气中主要有二氧化硫,熟料中主要是氧化铝,氧化铝溶解在氢氧化钾溶液中,得到偏铝酸钾溶液,用稀硫酸调节PH值,可得氢氧化铝沉淀和硫酸钾溶液,从硫酸钾溶液中可得硫酸钾晶体,据此答题.
解答 解:根据题中工业流程可知,明矾石与硫在加热的条件下生成二氧化硫和氧化铝,所以炉气中主要有二氧化硫,熟料中主要是氧化铝,氧化铝溶解在氢氧化钾溶液中,得到偏铝酸钾溶液,用稀硫酸调节PH值,可得氢氧化铝沉淀和硫酸钾溶液,从硫酸钾溶液中可得硫酸钾晶体,
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2,炉气的主要成份是二氧化硫,其一种用途为用于工业制硫酸,
故答案为:2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2;用于工业制硫酸;
(2)反应②为Al2O3与氢氧化钾的反应,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)③中调节pH不能用CO2,因为偏铝酸钾与二氧化碳反应会生成碳酸钾,使制备的K2SO4中有杂质,
故答案为:偏铝酸钾与二氧化碳反应会生成碳酸钾,使制备的K2SO4中有杂质;
(4)工业冶炼金属铝是用电解熔融的氧化铝的方法,阳极会产生氧气,阳极的碳块在高温时会与氧气反应,所以要定期更换补充阳极碳块,
故答案为:阳极会产生氧气,阳极的碳块在高温时会与氧气反应;
(5)纯净氢氧化铝经过受热分解,再电解可制得铝,涉及的反应类型都是分解反应,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,充当电池的正极,铝发生氧化反应充当电池的负极,所以电池负极的电极反应式是Al-3e-+4OH-=AlO2-+2H2O,
故答案为:分解反应;Al-3e-+4OH-=AlO2-+2H2O;
(6)现有明矾石1625t,按上述流程制得780tAl(OH)3,根据明矾石的化学式K2SO4•Al2(SO4)3•2Al2O3•6H2O可知,明矾石中铝元素与钾元素的物质的量之比为3:1,780tAl(OH)3中铝元素的物质的量为$\frac{780}{78}$×106mol=1×107mol,所以钾元素的物质的量为$\frac{1}{3}$×107mol,根据元素守恒可知,明矾石中钾元素的质量分数为$\frac{\frac{1}{3}×1{0}^{7}×39}{1625×1{0}^{6}}$=0.08=80%,
故答案为:80.
点评 本题以铝、铁的化合物为载体考查了物质间的反应、物质的分离和原电池、化学计算等知识点,明确物质之间的反应是解本题关键,这种综合性较强的题型是高考热点,须利用基础知识细心分析解答,题目难度中等.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
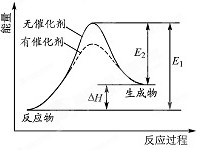 某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 催化剂能降低反应的活化能 | |
| C. | 催化剂能改变反应的焓变 | |
| D. | 逆反应的活化能大于正反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此反应是氧化还原反应 | |
| B. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| C. | 在反应中N2O4做还原剂 | |
| D. | R的分子式为C2H8N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com