
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段,氮元素的常见化合价与部分物质类别的对应关系如图所示。
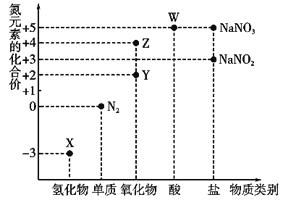
(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有______(填化学式)。
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_______________。尾气中的NO用酸性NaClO溶液吸收,其原理是HClO氧化NO生成Cl和NO3-,其离子方程式为______________________________________。
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为_______________________。
(4)W的稀溶液与铜单质发生反应的离子方程式为__________________________。
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为__________________________。
【答案】NO、NO2 2NH3+2O2 N2O+3H2O 3HClO+2NO+H2O=3Cl+2 NO3-+5H+ 试管内液面逐渐上升至试管容积的2/3左右,红棕色气体逐渐变为无色气体 3Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO↑+4H2O +2
N2O+3H2O 3HClO+2NO+H2O=3Cl+2 NO3-+5H+ 试管内液面逐渐上升至试管容积的2/3左右,红棕色气体逐渐变为无色气体 3Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO↑+4H2O +2
【解析】
由化合价可知X为NH3,Y为NO,Z为NO2,W为HNO3,
(1)从氮元素化合价变化的角度分析,如既有氧化性,也有还原性,则N元素化合价为中间价态;
(2)NH3与O2在加热和催化剂作用下生成N2O,类似于生成NO的反应,同时生成水;在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,反应后溶液呈酸性;
(3)二氧化氮与水反应生成NO和HNO3;
(4)稀硝酸与铜反应生成硝酸铜和NO;
(5)结合氧化还原反应得失电子守恒计算。
由化合价可知X为NH3,Y为NO,Z为NO2,W为HNO3,
(1)从氮元素化合价变化的角度分析,如既有氧化性,也有还原性,则N元素化合价为中间价态,可为NO、NO2;
(2)NH3与O2在加热和催化剂作用下生成N2O和水,反应的化学方程式为2NH3+2O2![]() N2O+3H2O;在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,反应后溶液呈酸性,则反应的离子方程式为3HClO+2NO+H2O=3Cl-+2NO3-+5H+;
N2O+3H2O;在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,反应后溶液呈酸性,则反应的离子方程式为3HClO+2NO+H2O=3Cl-+2NO3-+5H+;
(3)二氧化氮和水反应生成硝酸和一氧化氮:3NO2+H2O=2HNO3+NO,一氧化氮是无色气体,二氧化氮是红棕色气体,二氧化氮和水反应后气体压强减小,外界大气压不变,所以外界大气压对水作用而使水进入试管中,3体积NO2转化为1体积NO,所以现象为试管内液面逐渐上升至试管容积的2/3左右,红棕色气体逐渐变为无色气体;
(4)稀硝酸与铜反应生成硝酸铜和NO,反应的离子方程式为3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O;
(5)50mL0.01molL﹣1 NaNO2溶液中n(NaNO2)=0.05L×0.01mol/L=5×10﹣4mol,10mL0.02molL﹣1 KMnO4溶液中n(KMnO4)=0.01L×0.02mol/L=2×10﹣4mol,二者恰好完全反应时,设还原产物中Mn元素的化合价为x,则5×10﹣4mol×2=2×10﹣4mol×(7﹣x),解得x=+2。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。甲、乙、丙是由这些元素组成的化合物,M、N、P是这些元素对应的单质,甲常温下为液态,丙中滴入盐酸开始有沉淀,继续沉淀消失,其溶液呈碱性。上述物质间的转化关系如图所示。下列说法错误的是( )
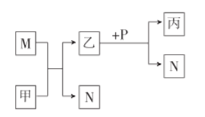
A.原子半径:Z>W>Y
B.X与Z形成的化合物能与水反应产生N
C.常温下,P不能与浓硝酸发生反应
D.Y分别与X、Z形成的化合物均不止一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3与NaHCO3的性质判断正确的是( )
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O5可用作食品的抗氧化剂。为测定某葡萄酒中Na2S2O5残留量,取50.00 mL葡萄酒样品,用0.01000 mol·L1的碘的水溶液与其反应,恰好消耗10.00 mL。下列说法正确的是( )
A.反应的离子方程式为:S2O52- + I2 + 3H2O = 2SO42- + 2I-+ 6H+
B.该反应转移电子数为1×10-3NA
C.该样品中Na2S2O5的残留量,若以SO2计为0.128 g·L1
D.反应结束后,所得溶液的pH比原溶液增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中绚丽的颜色变化往往展现了化学的神奇,体现了化学之美。下列变化中的a、b、c、d可以是混合物,关于物质类别或者反应类型的叙述一定正确的是
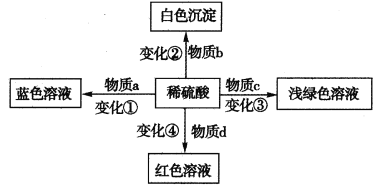
A.变化①一定不属于氧化还原反应
B.变化②得到的白色沉淀一定是硫酸盐
C.物质c中一定不能含有铁红或磁性氧化铁
D.物质d可能是某有机物的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国研究人员结合实验与计算机模拟结果,揭示了在金催化剂表面上水煤气变换的反应历程(如图所示),其中吸附在金催化剂表面上的物质用·标注。下列说法正确的是
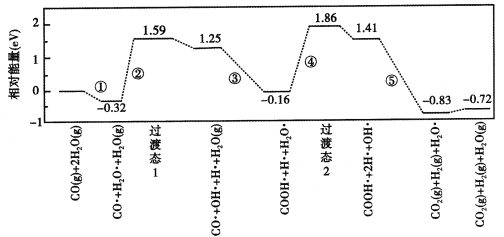
A.水煤气变换反应的△H<0
B.该历程中最大能垒(活化能)E正=1.70 eV
C.步骤⑤只有H-H键和H-O键形成
D.步骤③的转化关系可表示为:CO·+OH·+H2O(g)=COOH·+H2O·
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可分为许多种,如燃烧热和中和热等。
(1)10g氢气燃烧生成气态水,放出1209kJ热量,若H2O(1)=H2O(g) △H=+44kJ/mol,写出表示氢气燃烧热的热化学方程式:______。
(2)利用50mL0.25molL-1硫酸、50mL 0.55molL-1NaOH溶液,在如图所示装置中测定中和热,回答下列问题:
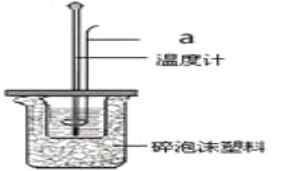
①仪器a的名称是_____。
②使用下列用品不是为了减小实验误差的是______。
A.两个量筒 B.仪器a C.泡沫塑料板 D.碎泡沫塑料
③向装有盐酸的小烧杯中倒入NaOH溶液的正确操作是____。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次性迅速倒入
④假设硫酸和氢氧化钠溶液的密度都是1gcm-3,又知中和反应后生成溶液的比热容c=4.18Jg-1℃-1,△t=3.4℃,该实验测得的中和热数值为____。(保留一位小数)
⑤下列操作不会使测量的中和热数值改变的是___。
A.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
B.结合日常生活实际该实验在保温杯中进行
C.用 0.275molL-1Ba(OH)2溶液代替氢氧化钠溶液
D.把仪器a改为铜制品
E.用60mL 0.5molL-1盐酸与50mL 0.55molL-1 NaOH溶液反应
F.用0.5molL-1醋酸代替硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解物质的量浓度相同、体积比为1∶3的 CuSO4和 NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O![]() 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
③2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
④2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
A. ①②③B. ①②④C. ②③④D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某硫酸试剂标签上的部分内容。下列说法错误的是( )

A.常温下,该硫酸可以用铁制容器运输
B.敞口放置的该硫酸因挥发而导致浓度变小
C.该硫酸的物质的量浓度为18.4molL﹣1
D.配制250mL0.4molL﹣1的稀硫酸需取该硫酸约5.4mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com