
| A. | Cl2:电解饱和食盐水 | B. | O2:过氧化氢与二氧化锰混合 | ||
| C. | H2:锌粒和稀硝酸混合 | D. | NH3:氮气和氢气混合 |
分析 从实验室制取常见气体的反应原理分析,可以从气体制取时药品的选择方面和生成物以及可操作性判断,
A.实验室用浓盐酸和二氧化锰加热反应生成,电解饱和食盐水得到气体为氢气、氯气;
B.过氧化氢在二氧化锰做催化剂条件下分解生成水和氧气;
C.制取氢气常用稀硫酸或稀盐酸,不用稀硝酸;
D.氮气和氢气混合高温高压催化剂反应生成氨气为工业制备,实验室制备是氯化铵和氢氧化钙加热反应生成.
解答 解:A.实验室用浓盐酸和二氧化锰加热反应生成,MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,电解饱和食盐水不能制得纯净的氯气,故A错误;
B.实验室中用过氧化氢在二氧化锰做催化剂条件下分解生成水和氧气,2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,故B正确;
C.制取氢气常用稀硫酸或稀盐酸,不用稀硝酸,稀硝酸具有强氧化性和锌粒反应不能生成氢气,故C错误;
D.氮气和氢气混合高温高压催化剂反应生成氨气为工业制备,实验室制备是氯化铵和氢氧化钙加热反应生成,2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2,故D错误;
故选B.
点评 本题考查了气体实验室制备方法,主要是氧气、氯气、氨气、氢气的制备原理,题目较简单.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径/(10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A. | 由元素X和Q组成的化合物不可能含有共价键 | |
| B. | X、Z、R的最高价氧化物对应水化物可彼此反应 | |
| C. | Y-半径比Q2-半径大 | |
| D. | M(OH)2的碱性比XOH的碱性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
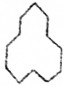 名称是环十二烷;1mol该烃完全燃烧需消耗的氧气18mol.
名称是环十二烷;1mol该烃完全燃烧需消耗的氧气18mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
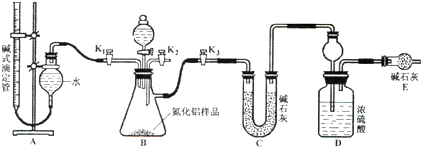
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
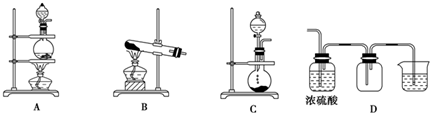
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制氧气时,用Na2O2或H2O2作反应物选择相同的气体发生装置 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化和干燥气体 | |
| C. | 制氢气时,用浓硫酸与锌反应比用稀硫酸快 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有大量SO32-溶液中:Na+、NH4+、SO42-、NO3- | |
| B. | 强碱性溶液中:NH4+、Ca2+、NO3-、Cl- | |
| C. | 强酸性溶液中:Cu2+、Mg2+、HCO3-、SO42- | |
| D. | 有大量Ba2+溶液中:K+、Ca2+、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液盛装在带有橡胶塞的试剂瓶中 | |
| B. | 少量金属钠保存在煤油中 | |
| C. | 向紫色石蕊试液中加入新制氯水,石蕊试液先变红后褪色 | |
| D. | 光导纤维中所用材料为晶体硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com