
【题目】在一定温度下,将2molSO2和1molO2充入一定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-197kJ·mol-1,当达到化学平衡时,下列说法中正确的是
2SO3(g)ΔH=-197kJ·mol-1,当达到化学平衡时,下列说法中正确的是
A.v正(O2)=2v逆(SO2)B.SO2和SO3共2mol
C.放出197kJ热量D.SO2和O2浓度相等
 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089 nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高 正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低 负化合价 | -2 | -3 | -1 | -3 |
(1)⑧号元素在周期表中的位置是______________________________;表格中元素处于同一主族的是__________________________________。 (用元素符号表示)
(2)元素①和⑥能形成两种化合物,写出这两种化合物的电子式_______________________;________________________。
(3)④和⑤元素最高价氧化物对应的水化物酸性较强的是________(用物质化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼[(CH3)2N—NH2]与N2O4是常用的火箭推进剂,火箭发射时常出现红棕色气体,发生的化学反应如下:
① (CH3)2N—NH2(l) + 2N2O4(l) = 2CO2(g) + 3N2(g) + 4H2O(g) H1<0
② N2O4(l) ![]() 2NO2(g) H2 >0
2NO2(g) H2 >0
下列说法不正确的是
A.反应①中,N2O4为氧化剂
B.反应①中,生成1mol CO2时,转移8 mol e-
C.由反应②推断:加压、降温是获得液态N2O4的条件
D.温度升高,反应①的化学反应速率减小、反应②的化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是
![]()
A.甲一定是金属元素
B.气态氢化物的稳定性:庚>己>戊
C.乙、丙、丁的最高价氧化物的水化物可以相互反应
D.庚的最高价氧化物的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,可逆反应2NO2![]() 2NO+O2在恒容密闭容器中进行,达到平衡状态的标志是
2NO+O2在恒容密闭容器中进行,达到平衡状态的标志是
①单位时间内生成nmolO2的同时生成2nmolNO2;
②单位时间内生成nmolO2的同时生成2nmolNO;
③混合气体的密度不再改变;
④混合气体的颜色不再改变;
⑤密闭容器中压强不再改变;
A.②③⑤B.①③⑤C.①④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、J、Q五种短周期主族元素的原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3∶8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一。请回答下列问题:
(1)Q元素在周期表中的位置是_______________________________________。
(2)这五种元素的原子半径从大到小的顺序为__________________(填元素符号)。
(3)元素的非金属性:Z________Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有________(填字母)。
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与它的+4价氧化物反应的化学方程式为________________________。
(5)X与Y可形成分子A,也可形成阳离子B,A与B都是10电子构型,写出阳离子B的电子式:__________,如何检验溶液中阳离子B的存在,请说出简要的实验方法:______,A的空间构型是______;实验室制备气体A的化学方程式:_______________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究KI和酸性KMnO4溶液的反应。
实验序号 | Ⅰ | Ⅱ |
实验操作 |
|
|
实验现象 | 紫色褪去,溶液变为棕黄色 | 紫色溶液迅速变为棕褐色悬浊液,然后沉淀消失,溶液变为棕黄色 |
资料:i. MnO4— 在酸性条件下最终被还原为Mn2+。ii. 酸性条件下氧化性: KMnO4>KIO3>I2 。
(1)实验1中溶液呈棕黄色,推测生成了________。
(2)实验小组继续对实验II反应中初始阶段的产物成分进行探究:
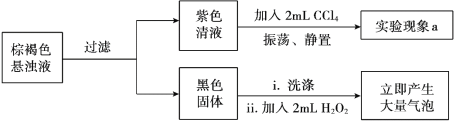
①经检验,实验II初始阶段I— 的氧化产物不是I2,则“实验现象a”为________。
②黑色固体是________。
③设计实验方案证明在“紫色清液”中存在IO3-:________。
④写出生成IO3-的离子方程式:________。
(3)探究实验II中棕褐色沉淀消失的原因。
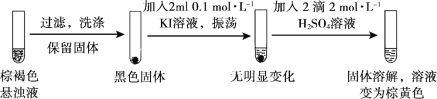
用离子方程式解释实验II中棕褐色沉淀消失的原因:________。
(4)实验反思:KI和酸性KMnO4溶液反应过程中,所得产物成分与________有关(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”。已知它易溶于水,难溶于乙醇,在中性或碱性环境中稳定,受热、遇酸易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
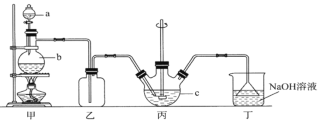
(1)装置甲中,a仪器的名称是____________;a中盛有浓硫酸,b中盛有亚硫酸钠,实验中要控制SO2生成速率,可以采取的措施有_________________________(写出一条即可)。
(2)装置乙的作用是____________________________________。
(3)装置丙中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2。反应的化学方程式为:________________________________________。
(4)本实验所用的Na2CO3中含少量NaOH,检验含有NaOH的实验方案为_________。(实验中供选用的试剂及仪器:CaCl2溶液、Ca(OH)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管.提示:室温时CaCO3饱和溶液的pH=9.5)
(5)反应结束后过滤丙中的混合物,滤液经蒸发、结晶、过滤、洗涤、干燥等得到产品,生成的硫代硫酸钠粗品可用_____________洗涤。为了测定粗产品中Na2S2O3·5H2O的含量,采用在酸性条件下用KMnO4标准液滴定的方法(假设粗产品中的杂质与酸性KMnO4溶液不反应)。称取1.50g粗产品溶于水,用0.20 mol·L-1KMnO4溶液(加适量稀硫酸酸化)滴定,当溶液中![]() 全部被氧化为
全部被氧化为![]() 时,消耗高锰酸钾溶液体积40.00mL。
时,消耗高锰酸钾溶液体积40.00mL。
①写出反应的离子方程式:________________________________________。
②产品中Na2S2O3·5H2O的质量分数为____________________(保留小数点后一位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com