
根据实验要求,回答下列问题:
(1)精制硫酸亚铁晶体(含少量不溶性杂质)时,将晶体溶于水后,为什么还需加热到50℃~80℃?为减少硫酸亚铁的损失,应采取什么分离方法?
(2)某溶液中含有OH-、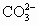 、
、 三种阴离子,要求只取一次待测液就能将阴离子都检验出来,试设计一种简便的检验方法(不选用指示剂).
三种阴离子,要求只取一次待测液就能将阴离子都检验出来,试设计一种简便的检验方法(不选用指示剂).
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| △ |
| ||
| △ |
| 8a |
| 29 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 利用右图装置测定金属镁的相对原子质量.请根据要求回答有关问题:(所提供试剂有:0.48克镁带、18.4mol?L-1的H2SO4、2.0mol?L-1的H2SO4)
利用右图装置测定金属镁的相对原子质量.请根据要求回答有关问题:(所提供试剂有:0.48克镁带、18.4mol?L-1的H2SO4、2.0mol?L-1的H2SO4)查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| 微热 |
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
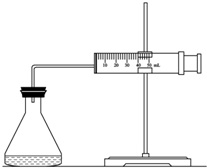 实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.| 实验编号 试剂 |
A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
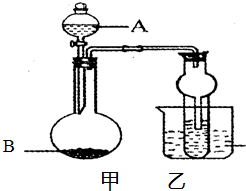 某同学设计如图所示的装置进行实验,请回答:
某同学设计如图所示的装置进行实验,请回答:| 编号 | 液体A | 固体B | 可制得的气体 |
| ① | 浓氨水 | NaOH | NH3 |
| ② | 稀硫酸 | Zn | H2 |
| ③ | 稀盐酸 | CaC03 | C02 |
| ④ | 双氧水 | Mn02 | Q |
| ⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com