
| A. | 5.6 g 铁在足量氯气中燃烧,转移电子数为0.2 NA | |
| B. | 1mol H3O+所含的电子数为11NA | |
| C. | 71 g氯气与足量铁反应得到的电子数一定为2NA | |
| D. | 16 g O2和O3的混合气体中,含O2分子数为0.5NA |
分析 A、求出铁的物质的量,然后根据铁与氯气反应后变为+3价来分析;
B、H3O+为10电子微粒;
C、求出氯气的物质的量,然后根据氯气与铁反应后变为-1价来分析;
D、混合物中氧气的质量百分含量不明确.
解答 解:A、5.6g铁的物质的量为0.1mol,而铁与氯气反应后变为+3价,故0.1mol铁反应后转移0.3mol电子即0.3NA个,故A错误;
B、H3O+为10电子微粒,故1molH3O+含10mol电子即10NA个,故B错误;
C、71g氯气的物质的量为1mol,而氯气与铁反应后变为-1价,故1mol氯气与铁反应后得到2mol电子即2NA个,故C正确;
D、混合物中氧气的质量百分含量不明确,故含有的氧气分子个数不能计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
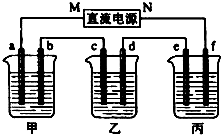 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液转移至容量瓶过程中不慎溅出 | |
| B. | 容量瓶中存在少量蒸馏水 | |
| C. | 溶液转移至容量瓶后,没有洗涤烧杯 | |
| D. | 定容时俯视刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸性溶液中:Mg2+、K+、SO42-、NO3- | |
| B. | 强碱性溶液中:Na+、Cu2+、H CO3-、NO3- | |
| C. | AgNO3 溶液中:H+、K+、SO42-、Cl- | |
| D. | Ba(NO3)2 溶液中:Mg2+、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都是金属元素 | B. | 它们的原子半径相差不大 | ||
| C. | 它们的最外层电子数相同 | D. | 它们的最高化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1L溶液中Cl-离子浓度为0.2mol•L-1 | |
| B. | 1L溶液中Ba2+离子浓度为0.2mol•L-1 | |
| C. | 1L溶液中Cl-离子总数为0.2NA | |
| D. | 1L溶液中Ba2+和Cl-离子总数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质
D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com