
| A. | ②①③⑧⑦⑥⑤④ | B. | ②①③⑥⑦⑧⑤④ | C. | ①②③⑧⑦⑥④⑤ | D. | ②①⑧③⑦⑥④⑤ |
分析 酸性溶液的pH<7、中性溶液的pH=7、碱性溶液的pH>7,且酸性越强,溶液的pH越小,碱性越强,溶液的pH越大;先根据溶液酸碱性对各物质进行分类,然后根据电解质的电离,盐的水解程度大小判断溶液中氢离子、氢氧根离子浓度,再判断溶液pH大小.
解答 解:酸性溶液:①HCl为一元强酸;
②H2SO4为二元强酸;
③CH3COOH为一元弱酸;
⑧NH4Cl溶液中,铵根离子水解,溶液显示酸性;
所以溶液的pH由小到大的顺序:②①③⑧;
碱性溶液:
④Ba(OH)2为二元强碱;
⑤KOH为一元强碱;
⑥NaF为强碱弱酸盐,溶液显示碱性;
所以溶液的pH由小到大的顺序:⑥⑤④;
⑦KCl是强酸强碱盐,其溶液呈中性;
通过以上分析知,这几种溶液的pH由小到大的排列顺序是:②①③⑧⑦⑥⑤④,
故选A.
点评 本题考查了弱电解质的电离及盐类水解,题目难度不大,根据“谁强谁显性、谁弱谁水解、强强显中性”确定盐溶液酸碱性,从而确定溶液pH大小.


科目:高中化学 来源: 题型:选择题
| A. | Al3+,Na+,NO3-,Cl- | B. | K+,Na+,Cl-,NO3- | ||
| C. | K+,Na+,Cl-,AlO2- | D. | K+,NH4+,SO42-,NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若正反应是吸热反应,则A为气态 | |
| B. | 若正反应是放热反应,则A为气态 | |
| C. | 改变压强对平衡的移动无影响 | |
| D. | 在平衡体系中加入少量C,则平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
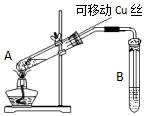 在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )
在探究Cu与浓H2SO4反应时,将质量8.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余4.8g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度约为( )| A. | 0.25mol•L-1 | B. | 0.5mol•L-1 | C. | 0.025mol•L-1 | D. | 0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2912 kJ | B. | 2953 kJ | C. | 3236 kJ | D. | 3836 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定存在K+、SO42-、CO32-、NH4+,可能存在Na+、Cl- | |
| B. | 一定存在K+、SO42-、CO32-、NH4+,一定不存在Cl-、Na+ | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Na+,一定不存在Cl- | |
| D. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Na+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com