
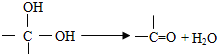
 试回答下列问题:
试回答下列问题:
 .它可以发生ab(填字母)
.它可以发生ab(填字母)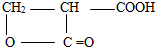 、
、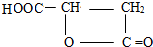 .
.分析 X分子式为C4H2Br2O4,为六元环化合物,碱性条件下水解、再酸化得到A与B,可推知X含有酯基,B氧化得到A,B能与氢气发生加成反应生成C,则B中存在-CHO,核磁共振氢谱表明其分子中只有一种类型H原子的吸收峰,则X为 ,故A为HOOC-COOH,B为OHC-CHO,C为HOCH2CH2OH,A与B发生酯化反应反应生成环酯D,以此解答该题.
,故A为HOOC-COOH,B为OHC-CHO,C为HOCH2CH2OH,A与B发生酯化反应反应生成环酯D,以此解答该题.
解答 解:X分子式为C4H2Br2O4,为六元环化合物,碱性条件下水解、再酸化得到A与B,可推知X含有酯基,B氧化得到A,B能与氢气发生加成反应生成C,则B中存在-CHO,核磁共振氢谱表明其分子中只有一种类型H原子的吸收峰,则X为 ,故A为HOOC-COOH,B为OHC-CHO,C为HOCH2CH2OH,A与B发生酯化反应反应生成环酯D,
,故A为HOOC-COOH,B为OHC-CHO,C为HOCH2CH2OH,A与B发生酯化反应反应生成环酯D,
(1)B为OHC-CHO,含有的官能团为醛基,故答案为:醛基;
(2)X为 ,含有酯基,可发生取代反应,含有Br原子,可发生消去、取代反应,故答案为:ab;
,含有酯基,可发生取代反应,含有Br原子,可发生消去、取代反应,故答案为:ab;
(3)A为HOOC-COOH,C为HOCH2CH2OH,二者按1:1混合,发生酯化反应生成链状酯的方程式为HOOC-COOH+HOCH2CH2OH$→_{△}^{浓硫酸}$HOOC-COOCH2CH2OH+H2O,
故答案为:HOOC-COOH+HOCH2CH2OH$→_{△}^{浓硫酸}$HOOC-COOCH2CH2OH+H2O;
(4)D有多种同分异构体,其中满足以下条件:a、能与NaHCO3溶液反应放出气泡,含有-COOH,b、能发生水解反应,含有酯基,c、分子内含有环状结构,符合条件的任意两种同分异构体的结构简式为: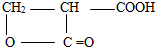 、
、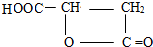 ,
,
故答案为: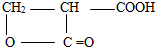 、
、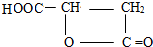 ;
;
点评 本题考查有机物推断与合成、官能团结构与性质、同分异构体等,为高考常见题型,侧重于学生的分析能力的考查,根据有机物的分子式与反应条件进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲一定是共价化合物,乙一定是离子化合物 | |
| B. | 甲一定是共价化合物,乙可能是共价化合物 | |
| C. | 甲可能是离子化合物,乙可能是共价化合物 | |
| D. | 甲一定是离子化合物,乙可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
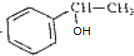
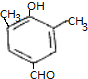 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LN0与02的混合气体含有的分子数为0.5NA | |
| B. | 常温下,1mol铁与足量的硫反应,转移电子为2NA | |
| C. | 常温常压下,22gC3H8中含有的共价键数8NA | |
| D. | 0.1mol/L的CH3COONa溶液20mL,含有CH3COO-数目为0.002NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 有机物 | 甲醇(CH3OH) | 丙烯(CH3CH=CH2) | 一氟甲烷(CH3F) |
| 相对分子质量 | 32 | 42 | 34 |
| 沸点/℃ | 64.7 | -47.4 | -78.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、Cu2+ | B. | H+、SO42-、HCO3- | C. | SO42-、Cl-、Na+ | D. | Ca2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com