
【题目】下列实验过程不能达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 测定NaOH溶液的浓度 | 用酸式滴定管量取20.00mL待测NaOH溶液,用甲基橙作指示剂,用标准浓度的盐酸进行滴定 |
B | 提高饱和氯水中的HClO浓度 | 向饱和氯水中加入碳酸钙粉末并通入适量Cl2,然后过滤 |
C | 加快铁片与盐酸的反应速率 | 向反应液中滴人几滴CuCl2溶液 |
D | 比较CdS(黄色)与CuS(黑色)的溶解度(已知 | 向H2S溶液中滴加0.01mol·L-1的CdSO4溶液至沉淀不再增加,然后滴入几滴0.01 mol·L-1CuSO4溶液,观察沉淀颜色变化 |
A. AB. BC. CD. D
【答案】A
【解析】
A、量取NaOH溶液应用碱式滴定管;
B、Cl2+H2O![]() H++C1-+HClO,是可逆反应,加入的CaCO3会与HCl反应而不与HClO反应;
H++C1-+HClO,是可逆反应,加入的CaCO3会与HCl反应而不与HClO反应;
C、形成Fe一Cu原电池;
D、由较难溶沉淀可转化为更难溶沉淀。
A、量取NaOH溶液应用碱式滴定管,故A项符合题意;
B、Cl2+H2O![]() H++C1-+HClO,加入的CaCO3会与HCl反应而不与HClO反应,再通入Cl2,均使平衡右移,故B项不符合题意;
H++C1-+HClO,加入的CaCO3会与HCl反应而不与HClO反应,再通入Cl2,均使平衡右移,故B项不符合题意;
C、形成Fe一Cu原电池,反应速率加快,故C项不符合题意;
D、由较难溶沉淀可转化为更难溶沉淀,所以通过观察沉淀是否由黄色变为黑色可比较CdS与CuS的溶解度,故D项不符合题意。
故选A。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】某NaCl溶液样品中含有Na2SO4、CaCl2杂质(该溶液用X表示),除去杂质的实验方案如图所示。

请回答:
(1)溶液B中存在的阳离子为____________,阴离子为___________。
(2)固体C中所含物质的化学式为__________。
(3)溶液D中加入适量盐酸后,大量减少的微粒为__________。
(4)①和②不能调换顺序的理由为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向2L恒容密闭容器中充入1mol NO2与2mol SO2发生如下反应:NO2(g)+SO2(g) ![]() SO3(g)+NO(g)△H=﹣41.8kJ/mol。
SO3(g)+NO(g)△H=﹣41.8kJ/mol。
(1)下列能说明该反应达到平衡状态的是_____________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗n mol SO3的同时生成n mol NO2
(2)反应进行到20s 时,测得反应速率v(NO)=0.005mol/(Ls) , 则消耗的NO2为_____mol。
(3)下列措施能使反应加快的是___(仅改变一个条件)
a.降低温度 b.缩小容积 c.使用效率更高的催化剂
(4)若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将__________。
a.延长 b.缩短 c.不变 d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的、以离子形式存在的碘元素。下图是实验室从海藻里提取碘的流程中的一部分。

下列判断正确的是
A. 步骤①③的操作分别是过滤、萃取
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤③中加入的有机溶剂是裂化汽油或乙醇
D. 步骤④的操作是过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.84 g的铜加入100 mL H2SO4和HNO3混合液中,铜全部溶解并放出无色气体。向溶液中加入2.70 g铝粉,充分反应后过滤,得到溶液X、滤渣Y和气体Z,气体Z遇空气不变色,在标准状况下的体积为672 mL。下列说法正确的是
A. 溶解铝粉的质量为0.54 g
B. 滤渣Y中可能只含有Cu
C. 原混合液中的c(H2SO4):c(HNO3)=9:4
D. 若向溶液X中加入100 mL 2.0 mol·L-1氢氧化钠溶液,充分反应,所得沉淀为4.68 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(主要成份是ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c(Mn+)=0.10mol·L–1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.3 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)写出ZnS的电子式__________________________;
焙烧过程中主要反应的化学方程式为__________________________。
(2)滤渣1的成分为:___________________;
(3)试剂Y是_________(只要求填写一种), 调PH值的范围是___________________。
(4)电解硫酸锌溶液制备单质锌时,电解的总反应离子方程式为:___________________。
(5)为将溶液中的Fe2+氧化,试剂X可选用的是_______。(填序号)
A.H2O2 B.H2S C.HNO3 D.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔、乙烯均是重要的化工原料。回答下列问题:
(1)1902年,Sabatier首次发现,常压下过渡金属可以催化含有双键或叁键的气态烃的加氢反应。
①已知:C2H2(g)+H2(g)═C2H4(g)△H1=-174.3kJ·mol—1
K1(300K)=3.37×1024
C2H2(g)+2H2(g)=C2H6(g)△H2═-311.0kJ·mol一l
K2(300K)═1.19×1042
则反应C2H4(g)+H2(g)═C2H6(g)的△H=___kJ·mol一1,K(300K)=__(保留三位有效数字)。
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。
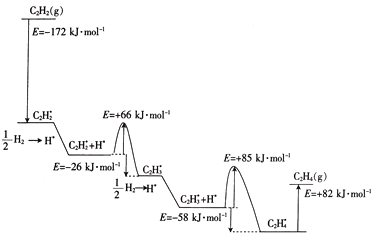
上述吸附反应为____(填“放热”或“吸热”)反应,该历程中最大能垒(活化能)为____kJ·mol-1,该步骤的化学方程式为____。
(2)在恒容密闭容器中充入乙烯,一定条件下发生反应C2H4(g)C2H2(g)+H2(g)。乙烯的离解率为a,平衡时容器内气体总压强为P总,则分压p(C2H4)═___(用p总和a表示)。
(3)用如图装置电解含CO2的某酸性废水溶液,阴极产物中含有乙烯。
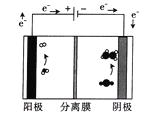
该分离膜为___(填“阳”或“阴”)离子选择性交换膜;生成乙烯的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置进行化学反应X+2Y=2Z能量变化情况的研究。当向试管中滴加试剂Y时,观察到U形管中液面甲处下降、乙处上升。下列关于该反应的叙述正确的是( )
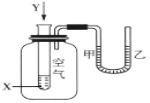
①该反应为放热反应
②该反应为吸热反应
③生成物的总能量比反应物的总能量高
④反应物的总能量比生成物的总能量高
⑤该反应过程可以看成贮存于X、Y内部的部分能量转化为热能而释放出来
A.仅①④⑤B.仅①④C.仅①③D.仅②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+ 3B(g)![]() 2C(g), 下列说法能证明这一 反应已经达到化学平衡状态的是
2C(g), 下列说法能证明这一 反应已经达到化学平衡状态的是
A.生成C的速率与分解C的速率相等.
B.A. B、C的分子数之比为1:3:2
C.A、B、C的浓度相等
D.单位时间消耗nmolA,同时生成2nmolC
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com