
����Ŀ�����л���AΪԭ�Ͽ��Ժϳ�ҩ��SERMs���м���E����ϳ�·��������
�ش�����������
��1��A�Ļ�ѧ����Ϊ_________��E�й����ŵ�����Ϊ________________��
��2��A��B�ķ�Ӧ����Ϊ________��B��C�ķ�Ӧ����Ϊ________________��
��3��B�Ľṹ��ʽΪ_________________��
��4����D����E�Ļ�ѧ����ʽΪ__________________��
��5����ȡ�������廯����W��E��ͬ���칹������������������W����___��(���������칹)��
��1molW��������������Һ����������Ӧ����4molAg
������FeCl3��Һ������ɫ��Ӧ
���к˴Ź�������Ϊ�����Ľṹ��ʽΪ_________________��
���𰸡� �䱽����(��1��3-������) �Ѽ����ʻ� ȡ����Ӧ �ӳɷ�Ӧ ![]()
 9
9 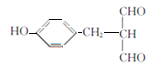
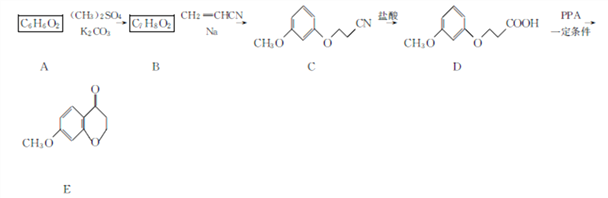
����������1�������л���C�Ľṹ�������A�ķ���ʽ��֪��AΪ�䱽���ӣ�����л���E�Ľṹ��ʽ��֪��E�й�����Ϊ�Ѽ����ʻ�����ȷ�𰸣��䱽����(��1��3-������)���Ѽ����ʻ���
��2��AΪ�䱽���ӣ����B�ķ���ʽ���л���C�Ľṹ��֪��BΪ![]() ������A��B�ķ�ӦΪȡ����Ӧ���л���B��CH2=CHCN�����ӳɷ�Ӧ����
������A��B�ķ�ӦΪȡ����Ӧ���л���B��CH2=CHCN�����ӳɷ�Ӧ����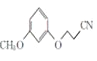 ����ȷ����ȡ����Ӧ���ӳɷ�Ӧ��
����ȷ����ȡ����Ӧ���ӳɷ�Ӧ��
��3��AΪ�䱽���ӣ����B�ķ���ʽ���л���C�Ľṹ��֪��BΪ![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��
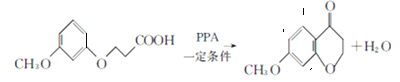
��4�����л���D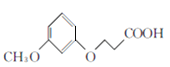 ����ȡ����Ӧ�����л���E
����ȡ����Ӧ�����л���E ����ѧ����ʽΪ��
����ѧ����ʽΪ�� ����ȷ����
����ȷ���� ��
��
��5���л���EΪ ����ȡ�������廯����W��E��ͬ���칹������1molW��������������Һ����������Ӧ����4molAg������2��ȩ����������FeCl3��Һ������ɫ��Ӧ�����з��ǻ����������ڱ����ϣ������������л����У�1��-OH ��1�� -CH2-CH(CHO)2 �ֱ����ڱ����������ڼ��������1��-OH ��1��-CH(CHO)-CH2-CHO�ֱ����ڱ����������ڼ��������1��-OH ��1�� -C(CH3)(CHO)2�ֱ����ڱ����������ڼ�����֣�������9�֣����к˴Ź�������Ϊ�����Ľṹ��ʽΪ
����ȡ�������廯����W��E��ͬ���칹������1molW��������������Һ����������Ӧ����4molAg������2��ȩ����������FeCl3��Һ������ɫ��Ӧ�����з��ǻ����������ڱ����ϣ������������л����У�1��-OH ��1�� -CH2-CH(CHO)2 �ֱ����ڱ����������ڼ��������1��-OH ��1��-CH(CHO)-CH2-CHO�ֱ����ڱ����������ڼ��������1��-OH ��1�� -C(CH3)(CHO)2�ֱ����ڱ����������ڼ�����֣�������9�֣����к˴Ź�������Ϊ�����Ľṹ��ʽΪ ����ȷ����9��
����ȷ����9�� ��
��


 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ڻ�������������ʮ����Ҫ�����ã��绯ѧ����NO3-��ԭ����ͼ��ʾ������˵������ȷ������ ��
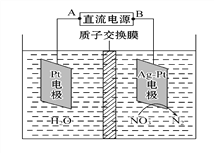
A. AΪ��Դ������
B. ��Һ��H+������������Ǩ��
C. �������У�ÿת��2 mol����,�����缫�Ͳ���32gO2
D. Ag-Pt�缫�ĵ缫��ӦʽΪ2NO3-+12H++10e- = N2��+ 6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ի�ѧ��Ӧ�ȵ�������������ǣ� ��
A.�κο��淴Ӧ����һ������
B.��ѧ��Ӧ�����Dz��ɸı��
C.��ѧ��Ӧ������ʱ��ij�����
D.��ѧ��Ӧ�ﵽ��ʱ�����淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮϡ��0.1mol/L��ˮʱ����Һ������ˮ�������Ӷ���С���ǣ�������
A.![]()
B.![]()
C.c��H+����c��OH�����ij˻�
D.OH�������ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��a��b��c��d��ԭ������֮��Ϊ45������Ԫ�ؾ�λ�ڲ�ͬ���塣a��������ۺ�����۴����͵���0��b���ʿ����뵼�������d����̬�⻯��������ۺ����ᶼ��ǿ�ᡣ����˵����ȷ����
A. ����Ԫ����b�ķǽ�������ǿ B. ԭ�Ӱ뾶��c>b
C. ����⻯����ȶ�����b>d D. ������bad3�д������Ӽ��ͼ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2�Ǻ��ɫ�ж��������д̼�����ζ���е�Ϊ11�棬��������ˮ������ˮ��Ӧ������ˮ����ˮ��ɴ����ᡢ����������������Ҳ�ֽ����������Һ�����䰵������ȶ���ijУ����ѧϰС���ͬѧ���Ʊ���������ˮ��Һ�����������ʡ�
��.��������ˮ��Һ�Ʊ���
��Բ����ƿ���ȼ���10gKClO3�����9gH2C2O4��2H2O(����)��Ȼ���ټ���5mLϡ�������ô�������������(����ͼ)������ƿ������ˮԡ�У�����ˮԡ�¶���60��80�棬��B�й��ƿ����Һ������ɫʱֹͣ���ȡ�
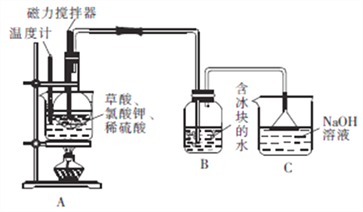
�ش�����������
��1��װ��A��ˮԡ���ȵ��ŵ���_________________��װ��A��ˮԡ�¶Ȳ��˵���60��Ҳ���˸���80�棬��ԭ����______________________��
��2��װ��A�з�Ӧ����ClO2��KHSO4�Ȳ���Ļ�ѧ����ʽΪ_________________��
��3��װ��B��ˮ�����������Ŀ����_________________��װ��C��������_______________
��.���ʵ����֤ClO2�������ԡ�
��4��ȡ����ClO2ˮ��Һ����H2S��Һ������������ɫ��Һ��������H2S����������������Ҫ�õ����Լ���_______________________��
��5��֤��ClO2�������Ա�Fe3+ǿ�ķ�����______________________��
��6��������ClO2ˮ��Һ����ʢ��MnSO4��Һ���Թ����������к�ɫ������������÷�Ӧ�����ӷ���ʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��CO2�ǻ�ʯȼ��ȼ�յ���Ҫ���
��1������0.02 molCO2��0.01molCO�Ļ������ͨ��������Na2O2 ������ܱ������У�ͬʱ���ϵ��õ��ȼ����ַ�Ӧ������������_________g��
��2����֪��2CO(g)+O2(g)=2CO2(g) ��H=-566.0 kJ��mol-1������Eo-o=499.0kJ��mol-1��
�ٷ�Ӧ��CO(g)+O2(g)![]() CO2(g)+O(g)�ġ�H=_________kJ��mol-1��
CO2(g)+O(g)�ġ�H=_________kJ��mol-1��
����֪2500Kʱ�����з�Ӧ��ƽ�ⳣ��Ϊ0.40��ijʱ�̸÷�Ӧ��ϵ�и�����Ũ�����㣺c(CO)��c(O2)=c(CO2)��c(O)�����ʱv(��)_________(�>�� ��������������v���棩��
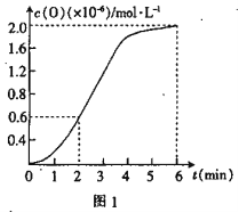
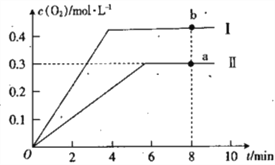
����֪1500��ʱ�����ܱ������з�����Ӧ��CO2(g)![]() CO(g)+O(g)����Ӧ������O(g)�� ���ʵ���Ũ����ʱ��ı仯��ͼ1 ��ʾ����0~2 min �ڣ�CO2 ��ƽ����Ӧ���� v(CO2)=_________��
CO(g)+O(g)����Ӧ������O(g)�� ���ʵ���Ũ����ʱ��ı仯��ͼ1 ��ʾ����0~2 min �ڣ�CO2 ��ƽ����Ӧ���� v(CO2)=_________��
��3����ij�ܱ������з�����Ӧ��2CO2(g)![]() 2CO(g)+O2(g),1molCO2 �ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ2 ��ʾ��
2CO(g)+O2(g),1molCO2 �ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ2 ��ʾ��

�����º��������£��ܱ�ʾ�ÿ��淴Ӧ�ﵽƽ��״̬����_________ (����ĸ)��
A��CO ������������ֲ���
B�������ڻ��������ܶȱ��ֲ���
C�������ڻ�������ƽ��Ħ���������ֲ���
D����λʱ���ڣ�����CO ��Ũ�ȵ�������CO2 ��Ũ��
������ͼ2����1500��ʱ��Ӧ�ﵽƽ��״̬�����������Ϊ1L�����ʱ��Ӧ��ƽ�ⳣ�� K=_________(����������1 λС��)��
��������ܱ������г���2molCO2(g)��������Ӧ��2CO2(g)![]() 2CO(g)+O2(g)������¶�ΪT��ʱ��������O2�����ʵ���Ũ����ʱ��ı仯������II ��ʾ��ͼ������I ʾ���������II���ı�һ�ַ�Ӧ������c(O2)��ʱ��ı仯����ı��������_________��a�� ������COŨ�ȱ仯��ʾ�ľ���Ӧ���ʹ�ϵΪva(CO)_________(�>����<����=��) vb( CO)��
2CO(g)+O2(g)������¶�ΪT��ʱ��������O2�����ʵ���Ũ����ʱ��ı仯������II ��ʾ��ͼ������I ʾ���������II���ı�һ�ַ�Ӧ������c(O2)��ʱ��ı仯����ı��������_________��a�� ������COŨ�ȱ仯��ʾ�ľ���Ӧ���ʹ�ϵΪva(CO)_________(�>����<����=��) vb( CO)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ������������ȷ���ǣ� ��
A.������������ˮ�������Ӽ����ƻ����й��ۼ����ƻ�
B.���ʷ����о������ۼ�
C.HF��HBr��ȣ������ڹ��ۼ���ǿ������HF�е����
D.�ɲ�ͬԪ����ɵĶ�ԭ�ӷ����ֻ���ڼ��Լ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com