
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的恒容密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是 ( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的恒容密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是 ( )
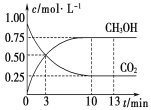
A. 3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
B. 从反应开始到平衡,H2的平均反应速率v(H2)=0.225 mol·L-1·min-1
C. 13min时,向容器中充入2 mol氦气,该反应的化学反应速率增加
D. 13min时,向容器中充入2 mol氦气,CO2的转化率增加
【答案】B
【解析】
试题A.3 min时,CH3OH和CO2的浓度相等,但是并没有达到平衡,用CO2的浓度表示的正反应速率与用CH3OH的浓度表示的逆反应速率不相等,故A错误;B.根据图像可知,10min时达到化学平衡,则从反应开始到平衡,二氧化碳的平均反应速率="=0.075" mol·L-1·min-1,根据反应速率之比等于方程式中化学计量数之比,则H2的平均反应速率0.225mol·L-1·min-1,故B正确;C.13min时,向容器中充入2mol氦气,因体积不变,则各组分浓度不变,该反应的化学反应速率不变,平衡不发生移动,CO2的转化率不变,故C错误;D.向容器中充入2mol氦气,该反应的化学反应速率不变,平衡不发生移动,CO2的转化率不变,故D错误;


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】如图所示,U形管内盛有150mL的溶液,按要求回答下列问题:
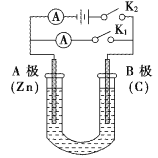
(1)打开K2,闭合K1,若所盛溶液为稀硫酸,则B极为___________极(填电极名称),该装置的能量转化形式为:__________,B极的电极反应式为:______________________。
(2)打开K1,闭合K2,若所盛溶液为NaCl溶液,一段时间后U形管内溶液的pH___________(填“变大”、“不变”或“变小”),总反应的化学方程式是:______________________。若要使U形管内溶液恢复到起始状态,应向U形管内的溶液加入(或通入)___________。
(3)如果要在铁块上镀上铜,打开K1,闭合K2,电解液选用CuSO4溶液,则A电极的材料应换成是___ (填“铁块”或“纯铜”),反应一段时间后电解质溶液中Cu2+的浓度将会_____ (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、R在元素周期表中的相对位置如图所示,其中R元素的常见单质为气体,下列判断不正确的是( )

A.原子半径:Z>X> Y
B.非金属性:R>W> Z
C.X、Z对应的含氧酸均为强酸
D.Y的最简单氢化物的沸点比X的高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
A. υ(A)=0.2mol/(L·min) B. υ(B)=0.9mol/(L·min)
C. υ(C)=0.5mol/(L·min) D. υ(D)=0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为
A. 2:1:1
B. 1:1:2
C. 1:2:1
D. 4:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是()

A. 电流从左侧电极经过负载后流向右侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-===N2+6H+
D. 当有4.48 L NO2被处理时,转移电子数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、 101kP下,1g硫粉完全燃烧放出9kJ的热量,写出表示该反应燃烧热的热化学方程式为__________________________
(2)Cl2和H2O(g))通过灼热的炭层,生成HCl和CO2,当有2mol电子转移时反应释放出145kJ热量,写出该反应的热化学方程式:___________________________ .
(3)已知拆开1molH-H键,1molCl-Cl键,1molH-Cl键,分别需要的能量是436kJ、243kJ、431kJ,则Cl2与H2反应生成HCl的热化学方程式为 _______________________。
(4)已知:C(s)+O2(g) = CO2(g) ΔH=-393 kJ·mol-1
2CO(g)+O2(g) = 2CO2(g) ΔH=-566 kJ·mol-1
写出碳和氧气生成一氧化碳的热化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
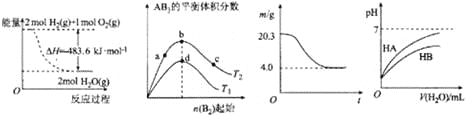
图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A. 图Ⅰ表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ·mol-1
B. 图Ⅱ表示反应A2 (g)+ 3B2 (g)![]() 2AB3(g),达到平衡时A2的转化率大小为:b>a>c
2AB3(g),达到平衡时A2的转化率大小为:b>a>c
C. 图Ⅲ表示0.1mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
D. 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式________________________________。
(2)铜能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。
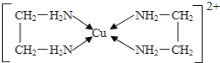
①Cu2+与乙二胺所形成的配离子中含有的化学键是_________________。
a.配位键 b.离子键 c.![]() 键 d.
键 d.![]() 键
键
②乙二胺分子中氮原子的杂化轨道类型为________________________,C、N、H三种元素的电负性由大到小顺序是________________________________。
③乙二胺和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是_______________。
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是_____________________________。(请结合原子的性质进行回答)
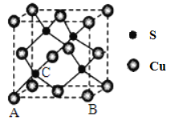
(4)Cu和S形成某种晶体的晶胞如图所示。
①该晶体的化学式为____________________
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为____________________。
③已知该晶体的密度为d g·cm-3,Cu2+和S2-的半径分别为a pm和b pm,阿伏加德罗常数值为NA。列式表示该晶体中原子的空间利用率______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com