
【题目】运用化学反应原理知识研究如何利用CO、SO2等有重要意义。
(1)用CO可以合成甲醇,已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;
O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;
CO(g)+![]() O2(g)=CO2(g)△H=-283.0kJmol-1;
O2(g)=CO2(g)△H=-283.0kJmol-1;
H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1;
O2(g)=H2O(l)△H=-285.8kJmol-1;
则CO(g)+2H2(g)![]() CH3OH(g)△H=___________kJmol-1.
CH3OH(g)△H=___________kJmol-1.
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是___________(填写序号).
a.使用催化剂;b.降低反应温度;
c.增大体系压强;d.不断将CH3OH从反应混合物中分离出来;
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醛,平衡转化率与温度、压强的关系如图1所示.
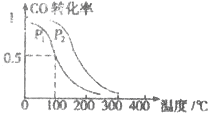
①P1___________P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=___________;
③100℃,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、 H2、CH3OH各0.5amol,则平衡___________(填“向左”“不”或“想右”)移动
(4)利用原电池原理,用SO2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触,请写出该电池的负极的电极反应式___________;
(5)CaSO3溶液与CaC12溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___________。用CaSO3溶液充分吸收SO2得NaHSO2溶液,然后电解该溶液,电解原理示意图如下图所示。请写出该电解池发生反应的化学方程式___________。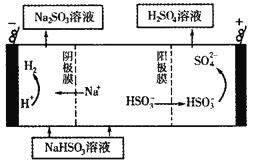
【答案】-90.1 ac 小于 (![]() )2 向左 O2+2H2O-2e- = 4H++SO42- 3.1×10-4mol/L 2NaHSO3+H2O
)2 向左 O2+2H2O-2e- = 4H++SO42- 3.1×10-4mol/L 2NaHSO3+H2O![]() Na2SO3+H2SO4+H2↑
Na2SO3+H2SO4+H2↑
【解析】
(1)由盖斯定律进行分析计算;
(2)增大浓度、温度,使用催化剂均可加快反应速率;
(3)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大;
②根据三段式进行计算,根据化学平衡常数K=![]() 进行计算;
进行计算;
③根据Qc与K比较,判断反应进行的方向;
(4)用SO2和H2O来制备硫酸,负极上二氧化硫失去电子生成硫酸;
(5)若混合前Na2SO3溶液的浓度为2×10-3molL-1,等体积混合后浓度为10-3molL-1,结合Ksp计算;由图可知电解产物,以此书写电解方程式。
(1)①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;②CO(g)+
O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;②CO(g)+![]() O2(g)=CO2(g)△H=-283.0kJmol-1;③H2(g)+
O2(g)=CO2(g)△H=-283.0kJmol-1;③H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1;由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)
O2(g)=H2O(l)△H=-285.8kJmol-1;由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)![]() CH3OH(g),△H=-283.0kJ/mol-285.8kJ/mol×2+764.5kJ/mol=-90.1kJ/mol,故答案为90.1;
CH3OH(g),△H=-283.0kJ/mol-285.8kJ/mol×2+764.5kJ/mol=-90.1kJ/mol,故答案为90.1;
(2)温度越高、压强越大,使用催化剂都可使反应速率增大,降低温度反应速率减慢,从体系中分离出甲醇,相当于减少浓度,反应速率减慢,故答案为ac;
(3)①由图1可知,温度相同时,在压强为P2时平衡时CO的转化率高,由反应CO(g)+2H2(g)![]() CH3OH(g)可知压强越大,越有利于平衡向正反应进行,故压强P1<P2;
CH3OH(g)可知压强越大,越有利于平衡向正反应进行,故压强P1<P2;
故答案为小于;
②由于平衡常数与压强没有关系,所以根据图象可知,在100℃P1时,CO的转化率是0.5,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L)![]()
![]() 0
0
转化浓度(mol/L)![]()
![]()
![]()
平衡浓度(mol/L)![]()
![]()
![]()
所以平衡常数K=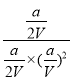 =(
=(![]() )2,故答案为(
)2,故答案为(![]() )2;
)2;
③100℃,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、 H2、CH3OH各0.5amol,此时Qc=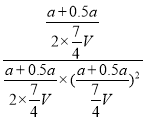 =(
=(![]() )2>K,平衡向左移动,故答案为向左;
)2>K,平衡向左移动,故答案为向左;
(4)①该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,故答案为SO2-2e-+2H2O═SO42-+4H+;
(5)根据CaSO3的Ksp=3.1×10-7,生成沉淀所需CaCl2溶液的最小浓度为 =3.1×10-4mol/L,电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+,阴极是溶液中的氢离子放电生成氢气,电解时的总反应为2NaHSO3+H2O
=3.1×10-4mol/L,电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+,阴极是溶液中的氢离子放电生成氢气,电解时的总反应为2NaHSO3+H2O![]() Na2SO3+H2SO4+H2↑。
Na2SO3+H2SO4+H2↑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000 mL溶液。除了烧杯外,还需要的玻璃仪器有_____________ 、____________、和_____________。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_______________式滴定管。
②滴定时眼睛应________.
③有关数据记录如下:
测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.50 |
2 | 20.00 | 1.20 | 21.20 |
(3)计算纯度:烧碱样品的纯度是_______。
(4)误差分析(填“偏高”,“偏低”,或“无影响”)
a. 酸式滴定管用蒸馏水洗后未用标准液润洗,就直接装入标准液,造成测定结果____________。
b、锥形瓶水洗后,又用待测液润洗,,测定结果____________。
c、用碱式滴定管取待测液时,滴定管尖嘴处有气泡未排出就取液入锥形瓶,造成测定结果____________。
d、滴定前,锥形瓶用水洗涤后,锥形瓶中残留水未干燥,造成最终结果___。
e、酸式滴定管,滴定前仰视读数,滴定后平视读数,造成测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )
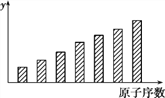
A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生活中有广泛的应用,回答下列问题。
(1)用K2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是____________(用离子方程式表示);但Fe3+净水要腐蚀设备,在腐蚀钢铁设备时,除H+作用外,另一主要原因是________________________________。
(2)钢铁腐蚀造成很大损失,用如图装置防止钢铁腐蚀(烧杯中均为食盐水),X极的电极材料应是________________(填字母)。

A、锌 B、铜 C、银 D、石墨
(3)高铁电池是一种新型的二次电池,电解液为碱性溶液,其反应式如下:
3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
①写出该电池放电时的正极反应式______________________________。
②如图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有______。
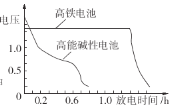
(4)从保护环境的角度考虑,制备K2FeO4较好的方法为电解法,其装置如图所示。
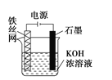
①石墨做电解池的______极(填“阴”或“阳”),溶液中OH-向_____移动(填“铁丝网”或“石墨”)
②电解过程中阳极的电极反应式为______________________________。
③若维持电流强度为6A,电解5小时,理论上可制得K2FeO4的质量为_________g(已知F=96500 C/mol,结果保留1位小数)
(5)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5 mol/L 500 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入____mL 2 mol/L的盐酸(滴加盐酸前后,溶液总体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1) A元素基态原子占据最高能级的电子云轮廓图为_________;B元素原子中未成对电子为_________,E元素原子核外由_________种运动状态不同的电子。
(2)写出C元素基态原子的电子排布式:_____________________。
(3)D元素的价层电子排布图为:_________________________。
(4)元素B与D的电负性的大小关系是B____________(填“>”“<”或“=”,下同)D,E与C的第一电离能大小关系是E________C。
(5)写出元素C的单质和元素E的最高价氧化物的水化物的水溶液反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。
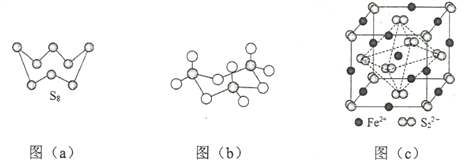
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则下列说法正确的是( )
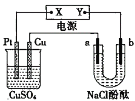
A.X是正极,Y是负极,CuSO4溶液的pH逐渐减小
B..X是正极,Y是负极,CuSO4溶液的pH保持不变
C.X是负极,Y是正极,CuSO4溶液的pH 逐渐减小
D.X是负极,Y是正极,CuSO4溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于恒温、恒容下的反应 2A(g) + 2B(g)3C(g) + D(g),达到平衡状态的是
A. 单位时间内生成 2n mol A,同时生成 3n mol C
B. 单位时间内生成 n mol B,同时消耗 0.5n mol D
C. 容器内压强不随时间而变化
D. 容器内混合气体的密度不随时间而变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com