
| A. | +45 kJ/mol | B. | +32.7 kJ/mol | C. | -45 kJ/mol | D. | 无法计算 |
分析 0.1mol/LMOH溶液的pH约为11,该溶液与0.1mol/L的硫酸溶液混合生成1molM2SO4时放出的热量为24.6kJ,即2MOH(aq)+H2SO4(aq)=M2SO4(aq)+2H2O(l),△H=-24.6kJ/mol,稀硫酸的中和热为57.3kJ/mol,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,根据盖斯定律来计算化学反应的焓变即可.
解答 解:0.1mol/LMOH溶液的pH约为11,该溶液与0.1mol/L的硫酸溶液混合生成1molM2SO4时放出的热量为24.6kJ,即①2MOH(aq)+2H+(aq)=2M+(aq)+2H2O(l),△H=-24.6kJ/mol,稀硫酸的中和热为57.3kJ/mol,②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,根据盖斯定律,$\frac{1}{2}$[①-②×2]得到:MOH(aq)?M+(aq)+OH-(aq),△H=$\frac{1}{2}$[-24.6kJ/mol-2(-57.3kJ/mol)]=45 kJ/mol.
故选A.
点评 本题考查学生盖斯定律的应用计算焓变、热化学方程式的书写知识,注意知识的迁移应用是关键,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
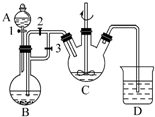 某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
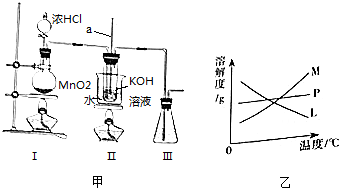
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X的常见氢化物水溶液显弱碱性 | |
| B. | 组成为HZO的物质结构式为H-Z-O | |
| C. | 最高价氧化物对应水化物酸性:Z>X>Y | |
| D. | 简单离子半径:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
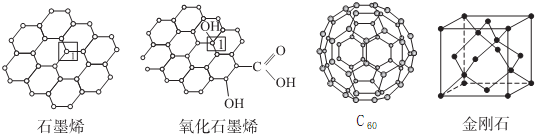
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA | |
| B. | 1mol镁与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 某密闭容器中盛有0.2molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性逐渐增强 | |
| B. | 化合价逐渐升高 | |
| C. | 失电子能力逐渐减弱 | |
| D. | 最高价氧化物对应的水化物碱性逐渐减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com