
【题目】在25℃时,将pH=11的NaOH溶液与pH=3的![]() 溶液等体积混合后,下列关系式中正确的是( )。
溶液等体积混合后,下列关系式中正确的是( )。
A.![]()
B.![]()
C.![]()
D.![]()
科目:高中化学 来源: 题型:
【题目】(1)提纯下列物质(括号内为杂质),填写所选用的除杂试剂和除杂方法
括号内为杂质 | 除杂试剂 | 操作 | |
1 | 乙烷(乙烯) | _____ | _____ |
2 | 乙酸乙酯(乙酸) | _____ | _____ |
3 | 苯(苯酚) | _____ | _____ |
4 | 乙醇(水) | _____ | _____ |
(2)以五倍子为原料可制得A,A结构简式如图所示,回答下列问题:
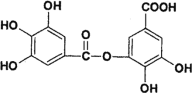
①A的分子式为_______________。
②有机化合物B在硫酸催化条件下加热发生酯化可得到A。写出B的结构简式为____________。
③写出A与过量NaOH溶液反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O,主要步骤如下:

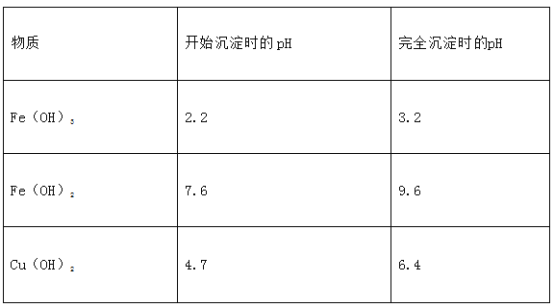
已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如下:

请回答下列问题:
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:__________(写一种)。
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是__________________________。根据如图有关数据,你认为工业上氧化操作时应采取的条件是__________________________。
(3)试剂②为CuO,其目的是调节溶液的 pH 保持在___________________范围。操作Ⅰ的名称是_________________。
(4)溶液 C 得到CuSO4·5H2O的主要步骤是__________________、________________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是
A. D元素处于元素周期表中第3周期第ⅥA族
B. 四种元素的原子半径:A<B<C<D
C. B、D的最高价氧化物具有相似的物理性质和化学性质
D. 一定条件下,B单质能置换出D单质,C单质能置换出A单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物异搏定路线中某一步骤如图所示,下列说法正确的是( )

A.物质 X 的分子式为 C8H10O2
B.物质 Y 可以发生水解、加成和氧化反应
C.物质 Z 中所有原子有可能在同一平面内
D.等物质的量的 X、Y 分别与 NaOH 反应,最多消耗 NaOH 的物质的量之比为 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等有重要意义。
(1)用CO可以合成甲醇,已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;
O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;
CO(g)+![]() O2(g)=CO2(g)△H=-283.0kJmol-1;
O2(g)=CO2(g)△H=-283.0kJmol-1;
H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1;
O2(g)=H2O(l)△H=-285.8kJmol-1;
则CO(g)+2H2(g)![]() CH3OH(g)△H=___________kJmol-1.
CH3OH(g)△H=___________kJmol-1.
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是___________(填写序号).
a.使用催化剂;b.降低反应温度;
c.增大体系压强;d.不断将CH3OH从反应混合物中分离出来;
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醛,平衡转化率与温度、压强的关系如图1所示.
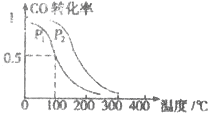
①P1___________P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=___________;
③100℃,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、 H2、CH3OH各0.5amol,则平衡___________(填“向左”“不”或“想右”)移动
(4)利用原电池原理,用SO2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触,请写出该电池的负极的电极反应式___________;
(5)CaSO3溶液与CaC12溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___________。用CaSO3溶液充分吸收SO2得NaHSO2溶液,然后电解该溶液,电解原理示意图如下图所示。请写出该电解池发生反应的化学方程式___________。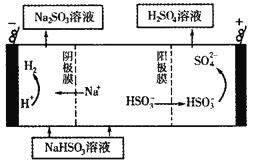
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20ml0.1mol/L某酸HA溶液中逐滴加入0.1mol/LNaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是( )。
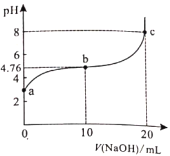
A.HA是弱酸B.b点溶液中:![]()
C.b、c之间一定存在![]() 的点D.a、b、c三点中,c点水的电离程度最大
的点D.a、b、c三点中,c点水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下的四份溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.将①④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性
C.将四份溶液分别稀释到原体积相同倍数后,溶液的pH:③>④,②>①
D.将②③混合,若pH=7,则消耗溶液的体积:②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着化学工业的迅猛发展及人口剧增,由此带来的环境污染已经引起全世界各国的普遍重视。
(1)空气质量报告中不涉及的物质是____________(填字母代号,下同)
A.SO2 B.NO2 C.PM2.5 D.CO2
(2)自来水通常要经过沉降悬浮物、杀菌消毒等过进行处理。下列物质中可以用来做混凝剂(或絮凝剂)的是____________。
A.漂白粉 B.明矾 C.活性炭
(3)装修材料中会释放出一些对人体有害的物质,试写出其中一种____________(填名称)
(4)汽车尾气中含有有毒的NO和CO气体。在汽车排气管上加装一个催化转化器,可使其发生反应生成两种大气中含有的无毒气体,写出该反应的学方程式_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com