
【题目】标准状况下,某同学向100mL H2S饱和溶液中通入SO2 , 所得溶液pH变化如图所示.下列分析中正确的是( ) 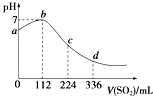
A.b点对应的溶液导电性最强
B.亚硫酸是比氢硫酸更弱的酸
C.ab段反应是SO2+2H2S═3S↓+2H2O
D.原H2S溶液的物质的量浓度为0.05molL﹣1
【答案】C
【解析】解:A.b点为中性,只有水,导电性最差,故A错误;
B.根据图象可知恰好反应时消耗二氧化硫112mL,n(SO2)= ![]() =0.005mol,根据方程式可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,溶液中亚硫酸为0.01mol,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性比氢硫酸更强,故B错误;
=0.005mol,根据方程式可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,溶液中亚硫酸为0.01mol,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性比氢硫酸更强,故B错误;
C.ab段pH在增大,由酸性到中性,则发生的反应是SO2+2H2S=3S↓+2H2O,故C正确;
D.由图可知,112mLSO2与硫化氢恰好完全反应,则n(SO2)= ![]() =0.005mol,由方程式可知n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为
=0.005mol,由方程式可知n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为 ![]() =0.1mol/L,故D错误.
=0.1mol/L,故D错误.
故选C.
H2S 饱和溶液中通入SO2 , 发生反应:SO2+2H2S=3S↓+2H2O,随着反应的进行,溶液酸性逐渐减弱,但恰好反应时,溶液呈中性,二氧化硫过量,与水反应生成亚硫酸,溶液酸性逐渐增强,根据图象可知恰好反应时消耗二氧化硫112mL,根据方程式可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性更强,以此解答该题.


科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaC1的流程如下:
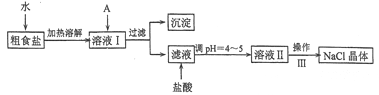
(1)加入A试剂,是为了除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子。A代表的是多种试剂,按滴加顺序依次为:iNaOH,ⅱ__________,ⅲ_________(填化学式)。
(2)请写出下列试剂加入试剂i时发生主要反应的离子反应方程式:_________
(3)右下图是某学生的过滤操作示意图,其操作不规范的是________(填标号)。
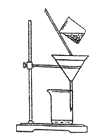
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(4)操作III的名称是__________
(5)mg粗盐提纯后得到ng纯净的NaCl固体,则m与n的大小关系为_________.
A.m>n B. m=n C. m<n D. 无法确定.
(6)实验室需配制480 mL0.400mol/L盐酸,现用如图所示浓盐酸配制,回答下列问题:
盐酸
分子式: HCl
相对分子质量: 36.5
密度: 1.2g/cm3
HCl的质量分数为: 36.5%
①配制需要的玻璃仪器有玻璃棒、量简、烧杯、________(填仪器名称)
②需量取浓盐酸的体积为:__________mL。(结果保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包NaHCO3和KHCO3的混合物样品.某研究性学习小组对其进行了如下探究,请按要求完成下列探究报告.
(1)【探究目的】实验测定样品中NaHCO3和KHCO3物质的量之比. 【探究思路】设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质的量之比.
【实验探究】实验装置如图甲所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).
如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积为mL.写出锥形瓶中反应的离子方程式 .
【结果处理】锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体体积(已换算成标准状况)与加入的稀硫酸的体积关系如图乙所示: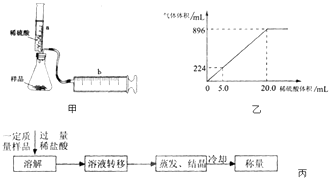
实验所用稀硫酸中溶质的物质的量浓度是mol/L.
(2)样品中NaHCO3和KHCO3物质的量之比为 . 【拓展探究】某同学设计了另一种方案,其操作流程如图丙:在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHCO3和KHCO3物质的量之比(选填“偏大”、“偏小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.34g FeSO47H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.下列说法中正确的是( ) 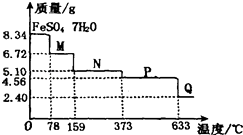
A.温度为78℃时固体物质M的化学式为FeSO4?5H2O
B.温度为l59℃时固体物质N的化学式为FeSO4?3H2O
C.在隔绝空气条件下由N得到P的化学方程式为FeSO4 ![]() ?FeO+SO3↑
?FeO+SO3↑
D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中,产生NO的反应为:N2(g)+O2(g)2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( ) 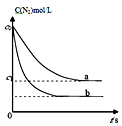
A.若曲线b对应的条件改变是温度,可判断该反应的△H<0
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.温度T下,该反应的平衡常数K= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。(ClO2中氯元素的化合价为+4价)
(1)浓盐酸在反应中表现出来的性质是_______(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)产生0.1molCl2,则转移电子的物质的量为________mol。
(3)用双线桥表示这个反应电子的转移情况2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
_____________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com