
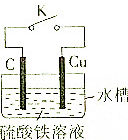
 某同学为了探究原电池原理,设计如图所示装置:
某同学为了探究原电池原理,设计如图所示装置:分析 (1)打开开关K,观察到锌片溶解,其反应实质是锌和酸发生置换反应;
(2)①原电池反应时,化学能转化为电能;铁离子在正极上得电子生成亚铁离子;
②Cu失电子为负极,石墨为正极;
③Mg、Cu构成原电池时,Mg失电子作负极.
解答 解:(1)打开开关K,观察到锌片溶解,表面产生大量气泡,铜片表面无明显现象,说明锌和酸发生置换反应、铜不发生反应,离子方程式为Zn+2H+═=Zn2++H2↑,故答案为:Zn+2H+═=Zn2++H2↑;
(2)①闭合K时,该装置为原电池,开始放电时,化学能转化为电能;铁离子在正极上得电子生成亚铁离子,所以溶液由黄色变为浅绿色;
故答案为:化学;浅绿色;
②Cu失电子为负极,石墨为正极,正极上铁离子得电子;
故答案为:正极;
③若用镁极替代石墨电极,关闭K并放电,Mg、Cu构成原电池时,Mg失电子作负极,负极的电极反应为:Mg-2e-=Mg2+;
故答案为:Mg-2e-=Mg2+.
点评 本题考查原电池知识,侧重于原电池的原理的应用的考查,注意把握电解方程式的书写以及原电池的工作原理,难度不大.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)>c(Na+) | B. | c(CH3COO-<c(Na+) | ||
| C. | c(CH3COO-)=c(Na+) | D. | 无法确定c(CH3COO-)与c(Na+)的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日常生活中常用无水乙醇做消毒剂 | |
| B. | 乙烯和苯都可以发生加成反应,都可以通过石油分馏得到 | |
| C. | 等物质的量的乙烯和乙醇完全燃烧时消耗氧气的质量相等 | |
| D. | 糖类、油脂、蛋白质都可以水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
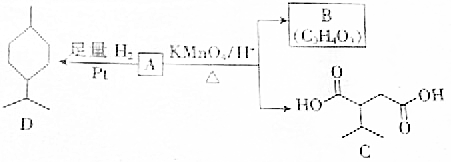
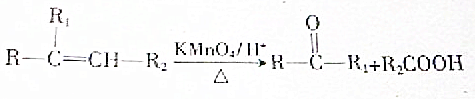
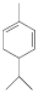 .A与等物质量的溴单质反应的产物有3种.
.A与等物质量的溴单质反应的产物有3种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
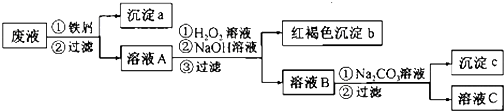
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:9 | B. | 9:1 | C. | 10:1 | D. | 1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com