
下列有关化学反应速率的说法不正确的是 ( )
A.化学反应达到最大限度时,正逆反应速率也达到最大且相等
B.催化剂能降低化学反应的活化能,加快反应速率,提高生产效率
C.用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率
D.用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性。把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅。一定条件下,在20L恒容密闭容器中发生SiCl4转化为SiHCl3 的反应:3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
(1)从反应开始到平衡,v(SiCl4)= 。
(2)该反应的平衡常数表达式为K= ,温度升高,K值增大,则Q 0(填“>”、“<”或“=”)。
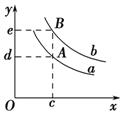 (3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(4)原容器中,通入H2的体积(标准状况下)为 。
(5)平衡后,将容器的体积缩为10 L,再次达到平衡时,
H2的物质的量浓度范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中充入N2和H2,合成NH3,到2秒末测得,v (H2) =0.45 mol / (L·s),则2秒末NH3的浓度为( )
A. 0.9 mol / L B. 0.45 mol / L C. 0.6 mol / L D. 0.55 mol / L
查看答案和解析>>
科目:高中化学 来源: 题型:
含氮化合物对人类生活有十分重大的意义。
(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合。
已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
①写出工业合成氨的热化学方程式: 。
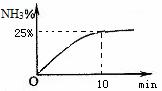 ②实验室模拟合成氨,在2L密闭容器中投入1molN2 和3mol H2,容器中氨气的体积分数随时间变化如图所示。则0~10min,NH3的平均速率为 ;达平衡时,N2的转化率为 。
②实验室模拟合成氨,在2L密闭容器中投入1molN2 和3mol H2,容器中氨气的体积分数随时间变化如图所示。则0~10min,NH3的平均速率为 ;达平衡时,N2的转化率为 。
③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH3,再达平衡时,N2的体积分数将 ,平衡常数 (填“增大”“减小”或“不变”)
(2)科学家一直致力于研究常温常压下“人工固氮”的方法。据报道:在常温常压条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水反应,生成NH3和一种单质。进一步研究NH3生成量与温度关系,部分实验数据如下(反应时间3h,其余条件一样)
| T/℃ | 30 | 40 | 50 |
| NH3生成量/10-6mol | 4.8 | 5.9 | 6.0 |
①写出常温下“人工固氮”反应的化学方程式: _
此反应△H 0(填“>”、“<”或“=)。
②该反应中的催化剂TiO2的制取方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。写出TiCl4水解的化学方程式: 。
③在上述固氮过程中,除加入催化剂外,能提高生产速率,但不降低产率的措施还可以是 。
A.适当升高温度 B.将氨气液化分离
C.增大反应物N2的浓度 D.增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温、恒容的密闭容器中进行反应A(g)==B(g)+C(g),若反应物的浓度由2 mol·L-1降到0.8 mol·L-1 需20 s,那么反应物由0.8 mol·L-1降到0.2 mol·L-1所需反应的时间为( )
A.10 s B.小于10 s
C.大于10 s D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示。下列叙述中正确的是 ( )
A.反应的化学方程式为5YX
B.t1时,Y的浓度是X浓度的1.5倍
C.t2时,正、逆反应速率相等
D.t3时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,10mL0.40mol/L H2O2溶液发生催化分解。不同时刻测定生成
O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液的浓度偏高的是 ( )
A.用量筒量取浓盐酸时俯视量筒刻度进行读数
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法都正确的是 ( )
①江河入海口三角洲的形成通常与胶体的性质有关
②四川灾区重建使用了大量钢材,钢材是合金
③“钡餐”中使用的硫酸钡是弱电解质
④太阳能电池板中的硅在元素周期表中处 于金属与非金属的交界位置
于金属与非金属的交界位置
⑤常用的自来水消毒剂有氯气和二氧化氯,两者都含有极性键
⑥水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物
A.①②③④ B.①②④⑥
C.①②⑤⑥ D.③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com