
现有下列仪器或装置,请回答下列问题:
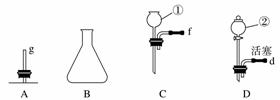
(1)仪器①的名称是__________________,②的名称是________________________。
(2)用上图仪器组装成气体发生装置:用KClO3和MnO2制O2应选的装置是________(填字母,下同);用废H2O2与MnO2制O2,并控制产生O2的速率,应选的装置是________。
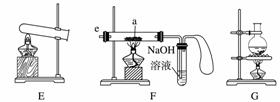
(3)若用装置X进行“排空气法”收集制取的O2,氧气应从__________(填“b”或“c”,下同)端导入。若瓶中装满水,用排水法收集氧气,氧气应从__________端导入。
(4)若用F装置进行CO还原Fe2O3的实验,实验室制取CO的方法一般采取甲酸脱水法(HCOOH CO↑+H2O),用纯净的CO完成该实验。
CO↑+H2O),用纯净的CO完成该实验。
①除F、X外还需要的装置有________,X中应加入的试剂是________,X与其他导管连接的顺序是______________________(填导管口的序号);
②实验时,a处的可能的现象为___________________________________________;
F装置中气球的作用是______________________________________________。
答案 (1)长颈漏斗 分液漏斗 (2)AE BD (3)c b (4)①DG 浓硫酸 dcbe ②红棕色粉末逐渐变黑
收集尾气中的一氧化碳,防止污染
解析 (2)KClO3和MnO2制O2属于“固+固 气体”,因而要选用E装置为气体发生装置;H2O2与MnO2制O2属于“固+液—→气体”且要控制产生气体的速率,只能用分液漏斗控制加入的H2O2的量。(3)使用X收集氧气时,用“排空气法”,由于O2的密度比空气的大,应从长管进气,用排水法收集气体,应从短管进气。(4)根据反应原理可知制取CO属于“液+液
气体”,因而要选用E装置为气体发生装置;H2O2与MnO2制O2属于“固+液—→气体”且要控制产生气体的速率,只能用分液漏斗控制加入的H2O2的量。(3)使用X收集氧气时,用“排空气法”,由于O2的密度比空气的大,应从长管进气,用排水法收集气体,应从短管进气。(4)根据反应原理可知制取CO属于“液+液 气体”,用分液漏斗控制加入浓硫酸的量,应选DG为气体发生装置,X的作用是除去CO中的水蒸气,洗气时气体流向为“长进短出”。
气体”,用分液漏斗控制加入浓硫酸的量,应选DG为气体发生装置,X的作用是除去CO中的水蒸气,洗气时气体流向为“长进短出”。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列是制备CuO的流程图:
工业CuSO4
 CuSO4溶液
CuSO4溶液 CuSO4·5H2O—→……—→CuO
CuSO4·5H2O—→……—→CuO
(1)步骤Ⅰ的目的是除去不溶性杂质。操作是________________________________________________________________________。
(2)步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是________________________________________________________________________
________________________________________________________________________。
(3)步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是
________________________________________________________________________(填操作名称),
过滤,水浴加热烘干。水浴加热的特点是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
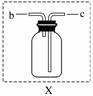
指出下图操作中的错误。
(1)________________________________________________________________________。
(2)________________________________________________________________________。
(3)________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列仪器:①集气瓶;②量筒;③烧杯;④表面皿;⑤蒸发皿;⑥容量瓶;⑦圆底烧瓶。其中能用酒精灯加热的是( )
A.②③⑤ B.③⑥⑦ C.①③④ D.③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属元素的叙述正确的是( )
A.金属元素的单质只有还原性,其离子只有氧化性
B.金属元素的单质在常温下均为固体
C.金属元素在不同化合物中化合价均相同
D.大多数金属元素的单质为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是三种稀酸对FeCr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )

A.稀硝酸对FeCr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是Fe+6HNO3(稀)===Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中盐酸的氢离子浓度最大,所以对FeCr合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对FeCr合金的腐蚀性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
在新制饱和氯水中,若只改变某一条件,下列叙述正确的是( )
A.再通入少量氯气, 减小
减小
B.通入少量SO2,溶液漂白性减弱
C.加入少量的碳酸钠粉末,pH增大,溶液漂白性增强
D.光照过程中,有气泡冒出,溶液的导电性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com