
| 滴定次数 | 待测溶液A的体积(mL) | KMnO4标准溶液的体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.10 | 20.12 |
| 第二次 | 20.00 | 2.20 | 24.20 |
| 第三次 | 20.00 | 4.30 | 24.28 |
分析 (1)浸泡液中含有残渣,可通过过滤得到澄清溶液;
(3)②KMnO4溶液具有强氧化性,能将碱式滴定管下端的橡胶管氧化;根据滴定时,眼睛注视锥形瓶中溶液颜色变化;根据KMnO4溶液自身的颜色作为指示剂判断滴定终点时,最后一滴溶液滴入,溶液由无色变红;
(4)酸性条件下高锰酸钾将草酸氧化为二氧化碳,自身被还原为锰离子;先判断滴定数据的有效性,求出标准液的平均体积,根据关系式2MnO4-~5C2O42-计算出C2O42-的质量,最后求出质量百分数;
(5)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$判断不当操作对相关物理量的影响;
解答 解:(1)该活动小组的同学取mg菠菜样品在研钵中研磨成汁,用足量热的稀硫酸溶液浸泡,由于浸泡液中含有残渣,可通过过滤得到澄清溶液;
故答案为:过滤;
(3)KMnO4溶液具有强氧化性,能将碱式滴定管下端的橡胶管氧化,所以不能用碱式滴定管量取,可以用酸式滴定管量取;
滴定时,眼睛注视锥形瓶中溶液颜色变化,以判定滴定终点;
高锰酸钾溶液颜色为紫红色,滴定终点时,溶液由无色变为红色,所以当最后一滴溶液滴入,溶液由无色变红,且30s内不复现,可达到滴定终点;
故答案为:酸式滴定管;锥形瓶中溶液颜色变化;溶液由无色变红,且30s内不恢复原色;
(4)酸性条件下高锰酸钾将草酸氧化为二氧化碳,自身被还原为锰离子,反应离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
三次滴定消耗标准液的体积分别为:20.02mL,22.00mL,19.98mL,第二次滴定数据误差过大,应该舍弃,其它两次消耗的标准液的平均体积为
20.00mL,
2KMnO4 ~5C2O42-
2mol 5mol
0.1000mol/L×0.02L n
解得:n=0.005mol
所以250mL溶液A中含有C2O42-的物质的量为0.005mol×$\frac{250}{20}$=0.0625mol,质量为:0.0625mol×88g/mol=5.5g,草酸盐(以C2O42-计算)的质量分数为$\frac{5.5g}{mg}$×100%;
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;$\frac{5.5g}{mg}$×100%;
(5)A.配制溶液时未洗涤烧杯和玻璃棒,待测液的浓度偏小,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定结果偏低,故A错误;
B.锥形瓶未干燥就直接加入待测液,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定结果不变,故B错误;
C.未用标准液润洗盛装标准液的仪器就加入标准液开始滴定,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定结果偏高,故C正确;
D.滴定前尖嘴处有气泡滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定结果偏高,故D正确;
E.滴定后俯视读数,造成V(标准)偏大小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定结果偏低,故E错误;
故选CD.
点评 本题主要考查了氧化还原滴定的操作步骤、滴定管的使用、误差分析,难度中等,掌握滴定的原理是解题的关键.


 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡常数 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
| A. | T1<T2 | |
| B. | K2=1.35 mol•L-1(或K2=1.35) | |
| C. | 混合气体的密度始终保持不变 | |
| D. | 乙容器中,当反应进行到1.5 min时,n(H2O)=1.4 mol. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMn04溶液鉴别乙烯和乙炔 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 苯和硝基苯采用分液的方法分离 | |
| D. | 分离沸点相差30℃以上的混溶液体,采用蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯含有的分子数为0.5NA | |
| B. | 3.2gCH4含有的化学键数为0.4NA | |
| C. | 足量的O2与1molNa充分反应,转移的电子数为NA | |
| D. | 25℃时,1.0LpH=13的Ba(0H)2溶液中含有的0H-数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| Z | W | Q |
| A. | X与Y可形成的化合物在5种以上 | |
| B. | 工业上常常通过电解Z的熔融氧化物的方法来获得Z的单质 | |
| C. | 这五种元素形成的简单离子的半径由大到小为:W>Q>X>Y>Z | |
| D. | W、Q两种元素形成的化合物每种原子最外层都达到了8e-稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO-) | |
| C. | 浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3•H2O)+c(NH4+)=0.1mol/L | |
| D. | pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
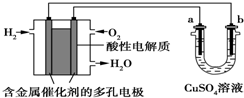
| A. | 燃料电池工作时,正极反应:O2+2H2O+4e-═4OH- | |
| B. | a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 | |
| C. | a极是粗铜,b极是纯铜时,随着反应的进行浓度减小 | |
| D. | a、b两极均是石墨时,在相同条件下b极产生的气体与电池中消耗的H2体积相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com