
| A. | 烧杯 | B. | 铁架台(带铁圈) | C. | 漏斗 | D. | 药匙 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 卤素单质与水反应的通式为X2+H2O═HX+HXO | |
| B. | HX都极易溶于水,它们的稳定性随核电荷数的增加而增强 | |
| C. | 卤素单质的颜色随相对分子质量的增大而加深 | |
| D. | X2的氧化性随核电荷数的增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
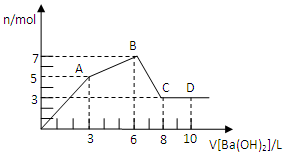 向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )| A. | 图中C点铝元素存在的形式是[Al(OH)4]- | |
| B. | 向D点溶液中通入过量CO2气体,立即产生白色沉淀 | |
| C. | 原混合溶液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| D. | OA段反应的离子方程式为:2Al3++3SO42-+3Ba2++8OH-═2Al(OH)4-+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO燃烧的热化学方程式为2CO(g)+O2(g)═2CO2(g)△H=-282.8kJ•mol-1 | |
| B. | H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ•mol-1 | |
| C. | 燃烧前混合气体中CO的体积分数为40% | |
| D. | 燃烧后的产物全部与足量的过氧化钠作用可产生0.125mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个甲醛分子由1个碳原子、2个氢原子、1个氧原子构成的 | |
| B. | 甲醛中碳、氢、氧三种元素的质量比为1:2:1 | |
| C. | 甲醛由碳、氢、氧三种元素组成的 | |
| D. | 甲醛中氧元素的质量分数为53.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H1 2H2(g)+O2(g)═2H2O(g)△H2 | |
| B. | S(g)+O2(g)═SO2 (g)△H1 S(s)+O2(g)═SO2 (g)△H2 | |
| C. | C(s)+O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | HCl(g)═H2(g)+Cl2(g)△H1 2HCl(g)═H2(g)+Cl2(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | SO2通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | SO2具有还原性 |
| B | 向NaSiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| C | 将盛有铜片的容器中加入浓硝酸 | 产生大量红棕色气体;溶液变为蓝绿色 | 浓硝酸具有强氧化性 |
| D | 浓硫酸滴到湿润的蔗糖中 | 蔗糖变成黑色海绵状 | 浓硫酸具有脱水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
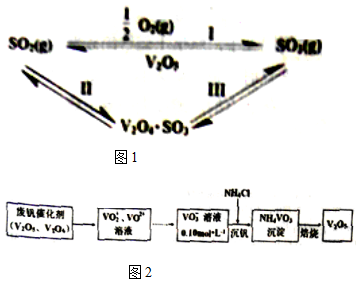
| 化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
| 能量/kJ | 535 | 472 | 496 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com