
| A、HI的生成速率与H2的生成速率相等 |
| B、H2的生成速率与I2的生成速率相等 |
| C、混合物的颜色不再发生变化 |
| D、H2、I2、HI的分子数之比为1:1:2 |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| A、①③ | B、①④ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
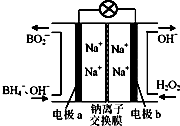 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A、电池放电时Na+从b极区移向a极区 |
| B、每消耗3 mol H2O2,转移的电子为3 mol |
| C、电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| D、该电池的负极反应式为:BH4-+8OH--8e-=BO2-+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为 NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ/mol |
| B、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol |
| D、已知2C(s)+2O2(g)═2CO2(g)△H1,;2C(s)+O2(g)═2CO(g)△H2;则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体与其他分散系的本质区别是粒子直径的大小 |
| B、Fe(OH)3胶体能产生丁达尔效应 |
| C、明矾净水是利用胶体的吸附性 |
| D、雾、豆浆、淀粉溶液属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com