

| 实验操作 | 实验现象与结论 |

分析 (1)稀释后的溶液呈酸性,根据仪器的精确度,量取25.00mL稀释后溶液需用酸式滴定管;
(2)通入Cl2的作用是将亚铁离子氧化为铁离子,氯气量不足时,“溶液B”中会含有亚铁离子;
(3)氯气的性质:能使石蕊试液先变红后退色,向溶液B中加入石蕊试液,如果石蕊试液显红色,后红色褪去,这是氯水的性质,证明含有氯气,若溶液变红后不褪色,溶液B不含有Cl2;
(4)一氧化碳可以和铁的氧化物之间发生反应,得到气体产物二氧化碳,干燥管B可以吸收生成的二氧化碳,测定二氧化碳的量可以获得铁触媒的量,但是要排除装置中空气成份的干扰,还要防止空气中二氧化碳和水蒸气进入B中;
(5)设发生的反应为:yCO+FexOy $\frac{\underline{\;\;△\;\;}}{\;}$xFe+yCO2,反应生成二氧化碳的质量是11.0g,根据方程式计算确定氧化物的化学式.
解答 解:(1)稀释后的溶液呈酸性,根据仪器的精确度,量取25.00mL稀释后溶液需用酸式滴定管,
故答案为:酸式滴定管;
(2)通入Cl2的作用是将亚铁离子氧化为铁离子,氯气量不足时,“溶液B”中会含有亚铁离子,即FeCl2或者FeSO4,
故答案为:FeCl2 或者FeSO4或者Fe2+;
(3)检验Cl2的具体方案为:取适量溶液B于试管中,滴加2-3滴紫色石蕊试液,振荡,观察现象;若溶液显红色,后红色褪去,则溶液B中含Cl2;若溶液变红后不褪色,则溶液B不含有Cl2,
故答案为:
| 实验操作 | 预期现象和结论 |
| 取适量溶液B于试管中,滴加2-3滴紫色石蕊试液,振荡,观察现象. | 若溶液显红色,后红色褪去,则溶液B中含Cl2; 若溶液变红后不褪色,则溶液B不含有Cl2 |
点评 本题考查物质组成探究实验,熟练掌握元素化合物性质,理解实验方案原理,是对学生综合能力的考查,难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳碳键键长:乙烯>苯 | B. | 密度:一氯乙烷>一氯丁烷 | ||
| C. | 热稳定性:NaHCO3>Na2CO3>H2CO3 | D. | 沸点:H2O>H2S>H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
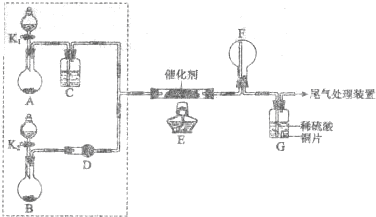

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图所示碱性锌锰电池中,负极电极反应为Zn-2e-═Zn2+ | |
| B. | 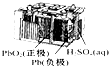 如图所示铅蓄电池放电过程中,硫酸浓度不断增大 | |
| C. |  如图所示电解精炼铜装置工作过程中,电解质溶液中Cu2+浓度始终不变 | |
| D. |  如图所示银锌纽扣电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.4 mo l•L-1 NaOH溶液 | B. | 5 mL 0.3 mo l•L-1 Na3PO4溶液 | ||
| C. | 10 mL 0.3 mo l•L-1 Na2SO4溶液 | D. | 5 mL 0.5 mol•L-1 NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
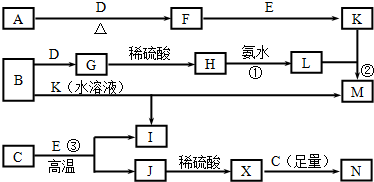
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 离子反应方程式 | |
| ①Mg(Al) | ||
| ②FeCl2溶液(FeCl3) | ||
| ③NaHCO3(Na2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com