
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 氯化硼中心原子采用sp杂化 | |
| C. | 氯化硼分子与氯化铝分子互为等电子体,都是非极性分子 | |
| D. | 氯化硼的熔沸点与氯硼键的键能大小有关 |
分析 A.氯化硼是共价化合物;
B.三氯化硼中的硼为sp2杂化;
C.根据原子总数及其价电子总数都相等判断等电子体,互为等电子体,结构相似;
D.氯化硼是分子晶体,熔点低说明分子间作用力小.
解答 解:A.氯化硼是共价化合物液态时不能导电,故A错误;
B.三氯化硼中心原子硼无孤对电子,为sp2杂化,故B错误;
C.氯化硼分子与氯化铝分子都含4个原子,价电子数都为24,所以互为等电子体,又三氯化硼中的硼为sp2杂化,无孤对电子,分子中键与键之间的夹角为120°,是平面三角形结构,为非极性分子,互为等电子体,结构相似,所以氯化硼分子与氯化铝分子互为等电子体,都是非极性分子,故C正确;
D.氯化硼是分子晶体,熔点低说明分子间作用力小,与硼氯键键能大小无关,故D错误.
故选C.
点评 本题考查原子轨道杂化,等电子体以及分子极性的判断等,难度适中,注意三氯化硼中的硼为sp2杂化,无孤对电子,分子中键与键之间的夹角为120°,是平面三角形结构.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ⑤ | C. | ④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在四面体结构单元,O 处于中心,Si 处于 4 个顶角 | |
| B. | 最小的环上,有 3 个 Si 原子和 3 个 O 原子 | |
| C. | 最小的环上,Si 和 O 原子数之比为 1:2 | |
| D. | 最小的环上,有 6 个 Si 原子和 6 个 O 原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
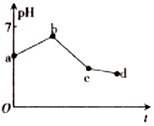 用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是( )
用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是( )| A. | ab段H+被还原,溶液的pH 增大 | |
| B. | cd 段相当于电解水 | |
| C. | c点时加人适量CuCl2固体,电解液可恢复原来浓度 | |
| D. | 原溶液中KCl和CuSO4的物质的量浓度之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨可用作制冷剂 | |
| B. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| C. | 用带磨口玻璃塞的试剂瓶盛放Na2CO3溶液 | |
| D. | 光纤通信的光导纤维是由石英经特殊工艺制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2和O3互为同素异形体 | |
| B. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H和${\;}_{1}^{3}$H互为同位素 | |
| C. | CH2═CH2和 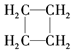 互为同系物 互为同系物 | |
| D. | 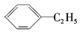 和 和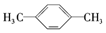 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水可制得黄绿色的氯气 | |
| B. | 氢气在氯气中安静地燃烧,发出黄色火焰,生成物溶于水可制得盐酸 | |
| C. | 工业上用Cl2和石灰乳为原料制造漂白粉 | |
| D. | Cl2能与铁反应生成氯化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铜及其化合物在日常生产、生活中有着广泛的应用.回答下列问题:
铁、铜及其化合物在日常生产、生活中有着广泛的应用.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com