
【题目】下图为Zn-Cu原电池的示意图,请回答:
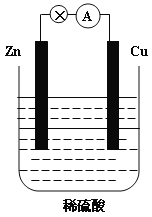
(1)锌片为原电池的______________(填“正”或“负”)极,该极的电极反应式是___________。该反应属于_______________(填“氧化”或“还原”)反应。
(2)__________(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+的从_________(填“锌片”或“铜片”)获得电子。
(3)原电池工作一段时间后,H2SO4溶液的浓度_________(填“增大”或“减小”,下同),烧杯中溶液的质量__________。
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为_________L(标准状况)。
【答案】负 Zn – 2e-= Zn2+ 氧化 电子 铜片 减小 增大 2.24
【解析】
(1)锌比铜活泼,锌片为原电池的负极,Zn发生氧化反应,电极反应式为Zn-2e-=Zn2+;故答案为负;Zn-2e-=Zn2+;氧化;
(2)原电池工作时,电子从锌片(负极)通过导线流向铜片(正极),铜为原电池的正极,发生还原反应,电极反应式为2H++2e-=H2↑,溶液中H+的从铜片获得电子;故答案为电子;铜片;
(3)电池总反应为Zn+2H+=Zn2++H2↑,由反应的方程式可知,原电池工作一段时间后,H2SO4溶液的浓度变小,溶液中每消耗2gH+,同时生成65gZn2+,烧杯中溶液质量增大;故答案为减小;增大;
(4)若锌片质量减轻6.5g,n(Zn)=6.5g÷65g/mol=0.1mol,根据电池总反应Zn+2H+=Zn2++H2↑,生成氢气物质的量为0.1mol,标准状况下体积为0.1mol×22.4L/mol=2.24L;故答案为2.24。


科目:高中化学 来源: 题型:
【题目】有机物烃A、B和C的结构如下图,下列有关说法正确的是
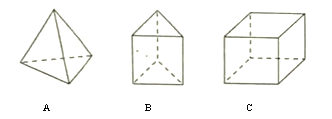
A. A的二氯代物结构有两种
B. B的分子式为![]()
C. 与C互为同分异构体且属于芳香烃的有机物可能使酸性高锰酸钾溶液褪色
D. A、B、C中只有C的最简式为CH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是
A | B | C | D |
|
|
|
|
烧杯中产生白色沉淀,一段时间后沉淀无明显变化 | 加盐酸出现白色浑浊,加热变澄清 | KMnO4 酸性溶液在苯和甲苯中均褪色 | 液体分层,下层呈 无色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A~K有如图的转化关系,其中D、E为气体单质,A、H为常见金属。试回答(图中有些反应的产物和反应的条件没有全部标出):
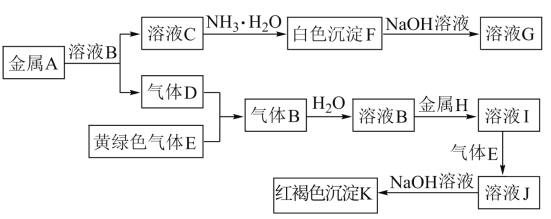
(1)写出下列物质的化学式:D是________, I是______。
(2)写出“C→F”反应的离子方程式:______________________________________。
(3)写出反应“J→K”的离子方程式:____________________________________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,三个干燥的烧瓶内分别装入:干燥纯净的氨气、含有部分空气的氯化氢气体、体积比为4∶1的二氧化氮与氧气的混合气体。分别做喷泉实验,最终三个烧瓶中所得溶液的物质的量浓度(假设溶液不外渗)之比为( )
A.2∶1∶2B.5∶5∶4C.1∶1∶1D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 L苯含有的分子数约为NA
B.密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA
C.1 L 0.1 mol·L-1的NaHCO3溶液中,HCO3- 和CO32- 离子数之和为0.1NA
D.密闭容器中1 mol N2(g)与3 mol H2 (g)反应制备氨气,形成6NA个N-H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
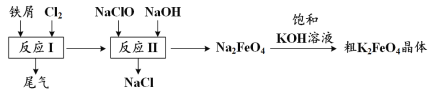
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4< K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______________(填化学式)。
(2)将X与Y混合,可生成淡黄色固体。该反应中氧化剂与还原剂的物质的量之比为_____________。
(3)检验物质Y的方法是______________________________。
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为____________。
(5)Na2S2O3是重要的化工原料,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_____________(填字母)。
a.Na2S+S b.Na2SO3+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24mL 0.05mol·L-1的Na2SO3溶液与 20mL 0.02mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
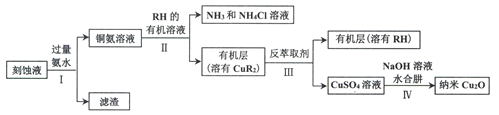
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A. 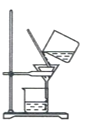 B.
B. 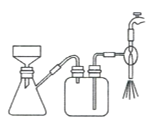 C.
C. 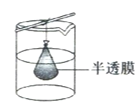
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com