
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
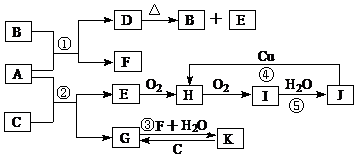
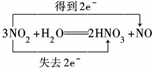 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是置换反应 | B. | 该反应中FeCl3作还原剂 | ||
| C. | 还原性:Fe>Cu | D. | 氧化性:CuCl2>FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
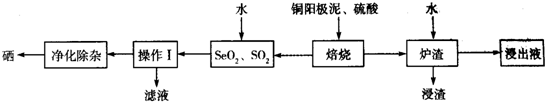

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
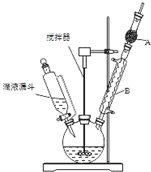 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.| 物质 | 沸点/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变温度和使用催化剂都能改变化学反应速率 | |
| B. | 利用丁达尔效应可以区别FeCl3溶液和Fe(OH)3胶体 | |
| C. | 根据△G=△H-T△S推测:△H<0的化学反应都可以自发进行 | |
| D. | 将AlCl3溶液蒸干并灼烧,所得固体为Al2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com