
分析 ①将NaNO3和Ba(NO3)2的混合物溶于足量的水中配成溶液.
②向混合液里加入过量的Na2CO3溶液,有白色沉淀生成碳酸钡,此时溶液中溶质为硝酸钠和碳酸钠;
③过滤,滤出沉淀并进行洗涤,得到较纯净的碳酸钡;
④向沉淀中加入硝酸,至沉淀完全溶解后,发生反应BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑,蒸发溶液得到晶体Ba(NO3)2;
⑤向滤液中加入硝酸,除去碳酸钠,发生反应Na2CO3+2HNO3=2NaNO3+H2O+CO2↑,至不再产生气泡为止;
⑥蒸发⑤中所得的溶液,得到晶体NaNO3;
结合题目分析解答.
解答 解:①将NaNO3和Ba(NO3)2的混合物溶于足量的水中配成溶液.
②向混合液里加入过量的Na2CO3溶液,有白色沉淀生成BaCO3,此时溶液中溶质为硝酸钠和碳酸钠;
③过滤,滤出沉淀并进行洗涤,得到较纯净的BaCO3;
④向沉淀中加入硝酸,至沉淀完全溶解后,发生反应BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑,蒸发溶液得到晶体Ba(NO3)2;
⑤向滤液中加入硝酸,除去碳酸钠,发生反应Na2CO3+2HNO3=2NaNO3+H2O+CO2↑,至不再产生气泡为止;
⑥蒸发⑤中所得的溶液,得到晶体NaNO3;
(1)实验②中得到的沉淀是BaCO3,实验④得到的晶体是Ba(NO3)2,实验⑥得到的晶体是NaNO3,
故答案为:BaCO3; Ba(NO3)2;NaNO3;
(2)为了把钡离子完全转化为碳酸钡沉淀,则加入的碳酸钠应该过量,答:加入过量碳酸钠的目的是把Ba2+全部转化为BaCO3沉淀;
(3)滤液中有剩余的碳酸钠,为了除去碳酸根离子,要加入稀硝酸,答:加入稀硝酸的目的是除去滤液中的CO32-;
(4)②④⑤中反应的化学方程式分别为Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3、BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑、Na2CO3+2HNO3=2NaNO3+H2O+CO2↑,
故答案为:Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3、BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑、Na2CO3+2HNO3=2NaNO3+H2O+CO2↑.
点评 本题考查物质的分离和提纯,为高频考点,明确物质的性质是解本题关键,注意每个步骤发生的反应及操作方法,熟悉实验原理,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Fe与足量盐酸反应,转移的电子数为0.3 NA | |
| B. | 28 g CO中所含的原子数为2 NA | |
| C. | 0.1 mol•L-1Na2CO3溶液中,含有CO32-数为0.1 NA | |
| D. | 标准状况下,22.4 L苯的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=b>0时,该反应达到化学平衡状态 | |
| B. | 该反应达到化学平衡状态时,一定有a=b | |
| C. | 当密闭容器内气体密度不再改变时,该反应达到化学平衡状态 | |
| D. | 该反应达到化学平衡状态时,密闭容器内气体的物质的量一定不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LHF分子中所含的原子数约为2NA | |
| B. | 1mol冰中,平均所含氢键的数目为NA | |
| C. | 在氧化还原反应中,1molH2O2转移的电子数为2NA | |
| D. | 13gCnHn分子中最多含C-C数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | Fe3+溶液中滴加过量的氨水:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H20 | |
| D. | NaHCO3的水解:HCO3-+H2O=CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
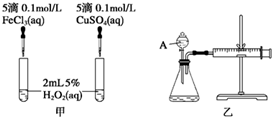
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请按要求回答下列问题:
请按要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com