
 请根据所学化学反应原理,解决以下问题:
请根据所学化学反应原理,解决以下问题:分析 (1)①在原电池中,活泼失电子的金属为负极,得电子的阳离子是电解质中的阳离子;
②依据原电池的电极反应和溶液中的电荷守恒分析判断离子移动方向;
③依据银电极做原电池的正极,在电极上是溶液中银离子得到电子发生还原反应;
④依据电解原理分析,阳极是溶液中氢氧根离子放电生成氧气,阴极上是溶液中银离子得到电子生成银;
(2)依据热化学方程式书写方法,标注物质聚集状态和对应量的反应热些出热化学方程式;
(3)①C(s)+O2(g)=CO2(g)△H1=-396.5kJ•mol-1
②H2(g)+1/2O2=H2O(g)△H2=-241.8kJ•mol-1
③CO(g)+1/2O2(g)=CO2(g)△H3=-283.0kJ•mol-1
根据盖斯定律,①-②-③计算得到.
解答 解:(1)①氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)中,活泼的失电子的金属Cu为负极,得电子的阳离子Ag+是电解质中的阳离子,所以电解质可以选择AgNO3溶液,故答案为:Cu;AgNO3溶液;
②原电池反应,B池中Ag+析出,为符合溶液的电中性,盐桥中的钾离子移向B池,故答案为:B;
③银电极发生的电极反应为溶液中的银离子得到电子析出银单质,电极反应为:Ag++e-=Ag,故答案为:Ag++e-=Ag;
④惰性电极电解硝酸银溶液,电极反应,①阳极是溶液中氢氧根离子放电生成氧气,4OH--4e-=2H2O+O2↑;②阴极上是溶液中银离子得到电子生成银,电极反应为:Ag++e-=Ag,总方程式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4HNO3+4Ag+O2↑;
故答案为:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4HNO3+4Ag+O2;
(2)16.0g气态肼(N2H4)物质的量为0.5mol,在氧气中完全燃烧生成氮气和水,放出热量312kJ,1mol气态肼(N2H4)燃烧放热614KJ,反应的热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,故答案为:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(3)①C(s)+O2(g)=CO2(g)△H1=-396.5kJ•mol-1
②H2(g)+1/2O2=H2O(g)△H2=-241.8kJ•mol-1
③CO(g)+1/2O2(g)=CO2(g)△H3=-283.0kJ•mol-1
根据盖斯定律,①-②-③得到:单质碳和水蒸气生成水煤气的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=128.3 kJ•mol-1
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+128.3 kJ•mol-1.
点评 本题考查学生原电池的设计、构成条件以及工作原理知识,盖斯定律的计算应用,注意知识的积累是解题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯气和水发生反应 Cl2+H2O═2 H++Cl-+ClO- | |
| B. | 金属钠和水反应 Na+2H2O═H2↑+2OH-+Na+ | |
| C. | 用氢氧化钠除去铝表面的氧化膜时产生气泡的反应2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 将金属铁加入稀硫酸和硝酸钾混合溶液中,金属溶解Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容量瓶中原有少量蒸馏水 | B. | 溶解所用的烧杯未洗涤 | ||
| C. | 定容时仰视观察液面 | D. | 定容时俯视观察液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用化学工艺调整织物孔隙直径,可以制作出防水透气面料 | |
| B. | 食品包装内常放置具有吸水性的化学药品以保持干燥,如生石灰和硅胶 | |
| C. | 合金广泛应用于现代建筑业,与金属晶体的韧性、可塑性有关 | |
| D. | 使用无铅汽油的汽车尾气不会污染空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验亚硫酸钠是否变质 | 先将亚酸钠样品溶于水配成溶液,然后加入足量稀盐酸酸化,再加入Ba(NO3)2溶液观察是否生成白色沉淀观察是否产生白色沉淀 |
| B | 除去苯中混有的苯酚 | 加入适量的溴水充分反应后过滤弃去沉淀 |
| C | 除去NaCl晶体中少量的KNO3杂质 | 先将晶体溶于水配成溶液,然后蒸发结晶并趁热过滤弃去滤液 |
| D | 检验CH3CH2Br中存在的溴元素 | 将CH3CH2Br与NaOH溶液共热,冷却后,取出上层水溶液,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
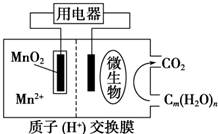
| A. | 正极反应式为MnO2+4H++2e-═Mn2++2H2O | |
| B. | 微生物所在电极区放电时发生还原反应 | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若用该电池给铅蓄电池充电,MnO2 电极质量减少8.7g,则铅蓄电池阴极增重9.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com