
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
下列说法正确的是
A.ΔH1<0,ΔH2>0
B.反应①②③的反应热满足关系:ΔH1-ΔH2=ΔH3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取降温措施
科目:高中化学 来源: 题型:
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
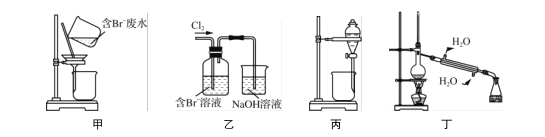
下列说法正确的是( )
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备有机氟化剂![]() 的反应
的反应![]() 。下列说法正确的是
。下列说法正确的是
A.NaF既不做氧化剂也不做还原剂,![]() 为氧化产物
为氧化产物
B.![]() 与
与![]() 两种物质中的氯元素化合价不同
两种物质中的氯元素化合价不同
C.还原剂与氧化剂物质的量之比为2:1
D.![]() 属于有机物
属于有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷的分子结构模型如图所示:

根据甲烷的分子结构模型,回答问题:
(1)甲烷的电子式是__,其含义是__。
(2)甲烷的结构式是__,其含义是_。
(3)甲烷分子的空间构型是__。
(4)更能真实反映甲烷分子结构模型的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃(含一个双键)组成,在同温同压下,混合气体对氢气的相对密度13,在标准状况下,将56L混合气体通入足量的溴水中,溴水的质量增重35g。
(1)计算确定混合气体中烃的化学式_____。
(2)混合气体中两种烃的物质的量之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验淀粉水解的情况,进行如图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6min,试管乙不加热。
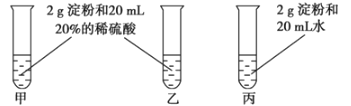
待试管甲中的溶液冷却后再进行后续实验。
实验①:取少量甲中溶液,加入新制氢氧化铜,加热,没有砖红色沉淀出现。
实验②:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验③:取少量丙中溶液加入氢氧化钠溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)写出淀粉水解的化学方程式_____________________。
(2)设计甲和乙是为了探究________对淀粉水解的影响,设计甲和丙是为了探究________对淀粉水解的影响。
(3)实验①失败的原因是_____________________________。
(4)实验③中溶液的颜色无明显变化的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请问该化学反应属于___(放热或吸热)反应,请写出该反应的热化学方程式:___。

②上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为285.8 kJ·mol-1,请写出氢气的燃烧热热化学方程式:___。
II.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1。回答有关中和反应的问题。
(1)如图装置中仪器A的名称__,碎泡沫塑料的作用是___。

(2)若通过实验测定中和热,其数值常常小于57.3kJ·mol-1,其原因可能是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类过多地使用化石燃料,造成了二氧化碳的大量排放,致使地球气温上升。二氧化碳是温室气体,也是一种重要的资源,如以CO2为基本原料可合成甲醇。回答下列问题:
(1)已知下列热化学方程式:
ⅰ.![]()
![]()
ⅱ.![]()
![]()
则ⅲ.![]()
![]() ________
________![]()
(2)Deluzarche等人在吸附有氢气的![]() 催化剂上通入CO2发生反应,该过程的反应机理如下:
催化剂上通入CO2发生反应,该过程的反应机理如下:

其中涉及非极性键变化的过程是______(填上图中的数字序号),写出上述过程中总反应的化学方程式:_____。
(3)一定条件下,向某密闭容器中按照![]() 投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:
投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:

由上图可知,反应物的转化率与压强的关系是:压强增大,CO2的转化率________(填“减小”“不变”或“增大”),温度为265℃时的平衡常数Kp=________![]() (Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(4)将一定量的![]() 、
、![]() 混合气体通入某密闭容器中,在催化剂作用下生成
混合气体通入某密闭容器中,在催化剂作用下生成![]() ,不同压强下,平衡时混合气体中
,不同压强下,平衡时混合气体中![]() 的体积分数随温度的变化如图所示。
的体积分数随温度的变化如图所示。

则A、B、C三点的平衡常数由大到小的顺序为____(用![]() 、
、![]() 、
、![]() 表示),E点变为D点的措施是____。
表示),E点变为D点的措施是____。
(5)以特殊的纳米材料为电极,一定浓度的硫酸作为电解质溶液,![]() 为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为_____。
为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,A(g)+3B(g)![]() 5C(g) ΔH>0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
5C(g) ΔH>0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是

A.加入适当催化剂B.增大压强C.增大反应物的浓度D.升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com