
【题目】在密闭容器中进行X2(g)+Y2(g)![]() 2Z(g)的反应,已知起始时其中X2、Y2、Z各物质浓度分别为0.1molL﹣1、0.3molL﹣1、0.2molL﹣1 , 反应达到平衡时,各物质浓度可能是( )
2Z(g)的反应,已知起始时其中X2、Y2、Z各物质浓度分别为0.1molL﹣1、0.3molL﹣1、0.2molL﹣1 , 反应达到平衡时,各物质浓度可能是( )
A.c(X)=0.2molL﹣1
B.c(Y2)=0.35molL﹣1
C.c(Y2)=0.2molL﹣1
D.c(Z)=0.4molL﹣1
【答案】B
【解析】解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(气)+Y2(气)2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.2 0.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(气)+Y2(气)2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.4 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0.2<c(Y2)<0.4,0<c(Z)<0.4,
故选B.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验操作正确的是
A.蒸馏实验中温度计的水银球应插入液态混合物中
B.用酒精萃取碘水中的碘
C.分液时,打开旋塞,使下层液体从下口流出,上层液体从上口倒出
D.开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法正确的是( )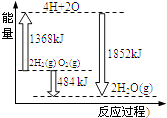
A.该反应是吸热反应过程
B.由2molH2和1molO2变成4molH、2molO原子需要放出能量
C.2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ能量
D.4molH、2molO生成2molH2O(g),共放出484kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质(括号中为杂质),采用的试剂和除杂方法错误的是( )
选项 | 含杂质的物质 | 试剂 | 除杂方法 |
A | C2H4(SO2) | NaOH溶液 | 洗气 |
B | C6H6(Br2) | Fe粉 | 蒸馏 |
C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
D | C2H2(H2S) | CuSO4溶液 | 洗气 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如图: 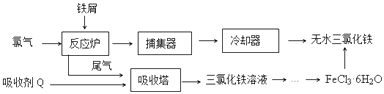
(1)由FeCl36H2O晶体制备无水FeCl3应采取的措施是: .
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入少量盐酸、、、过滤、洗涤、干燥.
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=molL﹣1 . (常温下Ksp[Fe(OH)3]=2.6×10﹣39)
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000molL﹣1Na2S2O3溶液滴定用去12.50mL.
已知:I2+2S2O32﹣=2I﹣+S4O62﹣
①写出加入稍过量的KI溶液反应的离子方程式.
②求样品中氯化铁的质量分数(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室里过滤一种浑浊溶液,发现滤出的液体仍浑浊。他检查实验装置发现漏斗外壁没有水,滤纸也未出现破损或小漏洞,则造成实验失败原因可能是下列操作中的
A.滤纸高出漏斗边缘的部分未剪掉
B.滤纸与漏斗之间有气泡未被排掉
C.倾倒液体时液面高于滤纸边缘
D.过滤时玻璃棒靠在一层滤纸一边
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:烃 A的摩尔质量为28g/mol,有关A的转化关系如图所示,请回答下列问题: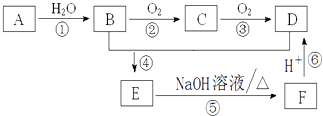
(1)C所含官能团的名称: , ①的反应类型为: .
(2)E的结构简式为: .
(3)B到C的化学方程式为: .
(4)E到F的化学方程式为: , 反应类型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。_____________________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___________。其中氮元素原子最外层电子排布的轨道表达式是_____________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是_______。醋酸二氨合铜中铜的配位数为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com