
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低。
②pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1。
③在Na2CO3和NaHCO3溶液中均存在下列关系c(Na+)+c(H+)=c(OH-)+c(HCO3)+2c(CO32-)
④反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;
则三者关系为:Ka·Kh=Kw
⑥反应A(g)![]() 2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则△H =(Ea -Eb)kJ·mol-1。其归纳正确的是
2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则△H =(Ea -Eb)kJ·mol-1。其归纳正确的是
A.①②③⑥ B.③④⑤⑥ C.②④⑤⑥ D.①③④⑤
科目:高中化学 来源: 题型:
【题目】T K时,向2.0L恒容密闭容器中充入0.10molCOCl2,发生反应![]() ,经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是:
,经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是:
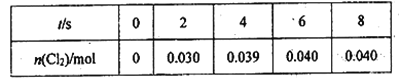
A. T K时该反应的化学平衡常数为![]()
B. 反应在前2s的平均速率![]() mol·L-1·s-1
mol·L-1·s-1
C. 保持其他条件不变,升高温度,若新平衡时c(C12)=0.038 mol·L-1,则反应的△H < 0
D. 平衡后向上述容器中再充入0.10molCOCl2,平衡正向移动,COCl2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KC1O3和草酸(H2C2O4)在60℃时反应制得。某学生用下图所示的装置模拟工业制取及收集C1O2,其中A为C1O2的发生装置,B为C1O2的凝集装置,C为尾气吸收装置。
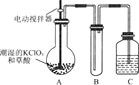
请回答下列问题:
(1)A中反应产物有K2CO3、C1O2和CO2等,请写出该反应的化学方程式:________________________。
A部分还应添加温水浴控制温度在60 °C,B部分还应补充什么装置:_________________。
(2)该装置按(1)补充完整后,装置A、B、C中还有一处设计明显不合理的是_____(填“A”“B”或“C”)。
(3)C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),该反应的离子方程式为____________。若实验时需要450 mL 4 mol L-1的NaOH溶液,则在精确配制时,需要称取NaOH的质量是____g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是
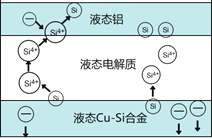
A. 在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
B. 电子由液态Cu-Si合金流出,从液态铝流入
C. 三层液熔盐的作用是增大电解反应面积,提高硅沉积效率
D. 电流强度不同,会影响硅提纯速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下述为制取Cu2O的两种方法:
方法a:用炭粉在高温条件下还原CuO
方法b:电解法,反应为2Cu+H2O ![]() Cu2O+H2↑
Cu2O+H2↑
(1)已知:①2Cu(s) + O2 (g)=Cu2O(s) △H1= akJ/mol
②C(s)+ ![]()
![]() O2 (g)=CO(g) △H2= bkJ/mol
O2 (g)=CO(g) △H2= bkJ/mol
③Cu(s)+ ![]()
![]() O2 (g)= CuO(s) △H3= ckJ/mol
O2 (g)= CuO(s) △H3= ckJ/mol
则方法a中反应的热化学方程式是:_________________。
(2)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度而制备纳米Cu2O装置如图所示:

①如图装置中D电极应连______电极。(填“A”或“B”)
②该离子交换膜为______离子交换膜(填“阴”或“阳”),该电解池的B极反应式为:____________________________________________。
③C极反应式为:____________________________。
(3)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:2H2O![]() 2H2(g)+O2(g)△H>0,水蒸气的浓度随时间t变化如表所示:
2H2(g)+O2(g)△H>0,水蒸气的浓度随时间t变化如表所示:

根据上述数据分析:
①催化剂的效率:实验①_______实验②(填“>”或“<”);
②通过实验①、③分析,T1______T2(填“>”或“<”);
③实验①、②、③的化学平衡常数K1、K2、K3的大小关系为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法不正确的是
A. 乙醇与乙酸都可以与钠反应
B. 油脂是油和脂肪的统称,都是高级脂肪酸与甘油形成的酯
C. 1mol有机物 一定条件下能和6molNaOH反应
一定条件下能和6molNaOH反应
D. 分于式为C4H7ClO2,可与NaHCO3溶液反应产生CO2的有机物可能结构有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯化氢分子中,形成共价键的原子轨道是( )
A.氯原子的2p轨道和氢原子的1s轨道
B.氯原子的2p轨道和氢原子的2p轨道
C.氯原子的3p轨道和氢原子的1s轨道
D.氯原子的3p轨道和氢原子的3p轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
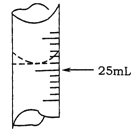
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=-130kJ·mol-1
CH3OH(l)+H2O(l) △H=-130kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1
CH3OH(l)的燃烧热△H=___________。
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) △H>0在不同温度下乙酸的生成速率变化如图所示。
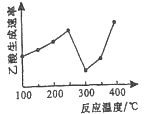
①当温度在250℃—300℃范围时,乙酸的生成速率减慢的主要原因是_________。
②欲使乙酸的平衡产率提高,应采取的措施是_____________(任写一条措施即可)。
(3)一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。
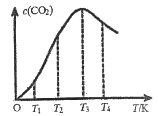
①下列能说明该反应达到平衡的是___________。
A.容器内混合物的质量不变
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,TC时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com