
【题目】以干海带为原料提取碘单质和氯化钾的过程主要分三步:完成下列填空:
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质.实验室灼烧海带应放在(填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是 .
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I﹣ , 制得富碘溶液.实验室模拟氧化过程的实验装置如图所示.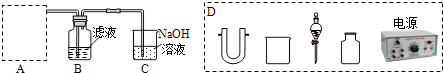
装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl﹣;二是电解法.限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是(选填编号).
a.2NaCl(s)+MnO2+2H2SO4(浓) ![]() MnSO4+Cl2↑+Na2SO4+2H2O
MnSO4+Cl2↑+Na2SO4+2H2O
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
d.4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
广口瓶B中发生反应的离子方程式是 . 装置C中NaOH的作用是 .
(3)步骤三:取100mL B中富碘溶液,按如下流程分离碘单质.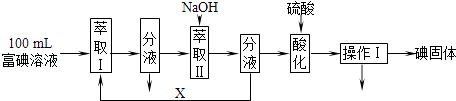
萃取Ⅱ和酸化过程发生的反应分别是:
3I2+6OH﹣→5I﹣+IO3﹣+3H2O;
5I﹣+IO3﹣+6H+→3I2+3H2O;
萃取剂X应选择(选填编号).
a.100mL苯b.10mL乙醇c.10mLCCl4d.10mL己烯
实验室进行萃取操作的仪器是 . 操作Ⅰ的名称是 .
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:①要用到的化学试剂是(填写化学式);
②要测定的物理量是 .
【答案】
(1)坩埚;加快溶解速率
(2)bd;Cl2+2I﹣=I2+2Cl﹣;吸收未反应的氯气,防止污染
(3)c;分液漏斗;过滤
(4)BaCl2或CaCl2;样品质量和干燥沉淀质量
【解析】解:(1)灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质.实验室灼烧海带应放在坩埚中加热,选用热水而不是冷水浸泡海带灰的目的是加快溶解速率,故答案为:坩埚,加快溶解速率;(2)氯气制备方法:一是在强酸性条件下用氧化剂氧化Cl﹣ , 实现该反应是常温下发生的氧化还原反应,据此选择实现此条件下的反应,二是电解法.限用图D中的仪器是电解饱和食盐水得到氯气,a.2NaCl(s)+MnO2+2H2SO4(浓) ![]() MnSO4+Cl2↑+Na2SO4+2H2O,反应需要加热,故a错误;b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O,此反应不需要加热常温下发生反应生成氯气,故b正确;c.2NaCl+2H2O
MnSO4+Cl2↑+Na2SO4+2H2O,反应需要加热,故a错误;b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O,此反应不需要加热常温下发生反应生成氯气,故b正确;c.2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,反应是通电电解氯化钠溶液,是工业氯碱工业原理,故C正确;d.4HCl(浓)+MnO2
2NaOH+Cl2↑+H2↑,反应是通电电解氯化钠溶液,是工业氯碱工业原理,故C正确;d.4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O,反应需要加热反应,故d错误;原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I﹣ , 制得富碘溶液,广口瓶B中是发生反应的离子方程式是 Cl2+2I﹣=I2+2Cl﹣ , 过量的氯气不能直接排放到空气中,用装置C中氢氧化钠溶液吸收,避免污染,故答案为:bc,Cl2+2I﹣=I2+2Cl﹣ , 吸收未反应的氯气,防止污染;(3)萃取剂X应选择不溶于水的有机溶剂且碘单质在其中溶解性大,a.苯不溶于水,碘单质在苯中溶解性大,但100mL苯的体积和溶液体积相同,萃取碘单质后浓度小,试剂浪费,故a错误;b.10mL乙醇和水溶液混溶,不能分层,不能做萃取剂,故b错误;c.10mLCCl4 和水溶液不溶,能分层且碘单质在其中溶解性大,可以做萃取剂,故c正确;d.10mL己烯和碘单质发生加成反应,不能做萃取剂,故d错误;故选c,取100mL B中富碘溶液,加入萃取剂X分液得到含碘单质的有机萃取剂,依据萃取原理可知,萃取剂X应选择不溶于水的有机溶剂且碘单质在其中溶解性大,萃取分液需要的仪器是分液漏斗,烧杯,分液后加入氢氧化钠溶液发生反应3I2+6OH﹣→5I﹣+IO3﹣+3H2O,分液得到有机萃取剂重新利用,吸收碘单质的氢氧化钠溶液中加入硫酸酸化,发生反应5I﹣+IO3﹣+6H+→3I2+3H2O,操作Ⅰ后得到碘单质固体,说明操作Ⅰ为过滤; 故答案为:c,分液漏斗,过滤;(4)用沉淀法测定氯化钾样品中K2CO3的质量分数,称量一定质量的样品,在烧杯中溶解,加入过量BaCl2或CaCl2溶液,沉淀碳酸根离子生成沉淀,过滤得到沉淀,洗涤、干燥,称量沉淀质量,计算沉淀物质的量,结合碳元素守恒,计算碳酸钾质量,进而得到碳酸钾的质量分数,①要用到的化学试剂是BaCl2或CaCl2 , 故答案为:BaCl2或CaCl2;②要测定的物理量是需要测定样品质量和干燥沉淀质量,故答案为:样品质量和干燥沉淀质量;
MnCl2+Cl2↑+2H2O,反应需要加热反应,故d错误;原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I﹣ , 制得富碘溶液,广口瓶B中是发生反应的离子方程式是 Cl2+2I﹣=I2+2Cl﹣ , 过量的氯气不能直接排放到空气中,用装置C中氢氧化钠溶液吸收,避免污染,故答案为:bc,Cl2+2I﹣=I2+2Cl﹣ , 吸收未反应的氯气,防止污染;(3)萃取剂X应选择不溶于水的有机溶剂且碘单质在其中溶解性大,a.苯不溶于水,碘单质在苯中溶解性大,但100mL苯的体积和溶液体积相同,萃取碘单质后浓度小,试剂浪费,故a错误;b.10mL乙醇和水溶液混溶,不能分层,不能做萃取剂,故b错误;c.10mLCCl4 和水溶液不溶,能分层且碘单质在其中溶解性大,可以做萃取剂,故c正确;d.10mL己烯和碘单质发生加成反应,不能做萃取剂,故d错误;故选c,取100mL B中富碘溶液,加入萃取剂X分液得到含碘单质的有机萃取剂,依据萃取原理可知,萃取剂X应选择不溶于水的有机溶剂且碘单质在其中溶解性大,萃取分液需要的仪器是分液漏斗,烧杯,分液后加入氢氧化钠溶液发生反应3I2+6OH﹣→5I﹣+IO3﹣+3H2O,分液得到有机萃取剂重新利用,吸收碘单质的氢氧化钠溶液中加入硫酸酸化,发生反应5I﹣+IO3﹣+6H+→3I2+3H2O,操作Ⅰ后得到碘单质固体,说明操作Ⅰ为过滤; 故答案为:c,分液漏斗,过滤;(4)用沉淀法测定氯化钾样品中K2CO3的质量分数,称量一定质量的样品,在烧杯中溶解,加入过量BaCl2或CaCl2溶液,沉淀碳酸根离子生成沉淀,过滤得到沉淀,洗涤、干燥,称量沉淀质量,计算沉淀物质的量,结合碳元素守恒,计算碳酸钾质量,进而得到碳酸钾的质量分数,①要用到的化学试剂是BaCl2或CaCl2 , 故答案为:BaCl2或CaCl2;②要测定的物理量是需要测定样品质量和干燥沉淀质量,故答案为:样品质量和干燥沉淀质量;
(1)灼烧固体应选择坩埚来加热灼烧,温度升高物质溶解度增大,热水能加快物质溶解的速度;(2)氯气制备一是在强酸性条件下用氧化剂氧化Cl﹣ , 实现该反应是常温下发生的氧化还原反应,据此选择实现此条件下的反应,二是电解法.限用图D中的仪器是电解饱和食盐水得到氯气,原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I﹣ , 制得富碘溶液,过量的氯气不能直接排放到空气中,用装置C中氢氧化钠溶液吸收避免污染;(3)萃取是一种常用的分离液﹣液混合物的方法,它是利用溶质在互不相溶的溶剂里溶解度的不同(溶质在萃取剂中的溶解度要大于在原溶剂中的溶解度),用一种溶剂把溶质从它与另一溶剂所组成的溶液里提取出来的操作,分液是把互不相溶的两种液体分开的操作,一般分液都是与萃取配合使用的;取100mL B中富碘溶液,加入萃取剂X分液得到含碘单质的有机萃取剂,分液后加入氢氧化钠溶液发生反应3I2+6OH﹣→5I﹣+IO3﹣+3H2O,分液得到有机萃取剂重新利用,吸收碘单质的氢氧化钠溶液中加入硫酸酸化,发生反应5I﹣+IO3﹣+6H+→3I2+3H2O,操作Ⅰ后得到碘单质固体,说明操作Ⅰ为过滤;(4)氯化钾样品中含K2CO3 , 测定K2CO3的质量分数,需要加入试剂沉淀碳酸根离子且不引入新的杂质,测定样品质量和生成沉淀质量,依据元素守恒计算碳酸钾的质量分数;


科目:高中化学 来源: 题型:
【题目】为了除去NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理。反应方程式:2NO2+2NaOH=NaNO3+NaNO2+H2O;NO2 +NO+2NaOH=2NaNO2+H2O 。现有由a mol NO、b mol NO2、 c mol N2O4组成的混合气体恰好被 V L NaOH 溶液吸收(无气体剩余),则此 NaOH 溶液的物质的量浓度为( ) mol/L
A. (a+b+c)/V B. 2(a+b+c)/3V C. (b+2c)/V D. (a+b+2c)/V
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A.NH3与HCl气体或CO2气体均不能共存
B.铵盐溶液与NaOH溶液混合后会有NH3逸出
C.硅、二氧化硅、硅酸、铵盐受热均很稳定
D.SiO2能溶解在NaOH溶液但不能溶解在氨水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定溶液的组成,还需检验的离子是( )
A.Na+
B.SO42-
C.Ba2+
D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的溶液,不用其他试剂,也不用焰色反应就能将它们区别开来的是( )
A.AgNO3 NaCl BaCl2 NaOH
B.K2CO3 KHCO3 HCl H2SO4
C.Na2CO3 HCl Ba(NO3)2 KCl
D.KNO3 NaCl BaCl2 (NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中氧元素的数据见如图,说法正确的是( ) 
A.氧元素的质量数是16
B.氧元素的相对原子质量是16.00
C.氧原子2p亚层有一个未成对电子
D.氧原子最外层有6个能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点.某电极的工作原理如图1所示,该电池电解质为能传导 Li+的固体材料.
(1)放电时,该电极为极,电极反应为
(2)充电时该电极连接外接电源的极
(3)放电时,电池负极的质量(减少、增加、不变)
(4)LiOH可做制备锂离子电池电极的材料,利用如图2装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.阴极区电解液为溶液(填化学式),离子交换膜应使用(阳、阴)离子交换膜.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO ![]() (aq)PbCO3(s)+SO
(aq)PbCO3(s)+SO ![]() (aq).Ksp (PbCO3)=1.5×10﹣13 , Ksp (PbSO4)=1.8×10﹣8某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(aq).Ksp (PbCO3)=1.5×10﹣13 , Ksp (PbSO4)=1.8×10﹣8某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(1)计算上述反应的平衡常数:K= .
(2)加入足量NaHCO3溶液也可实现该转化,写出离子方程式
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3Pb(OH)2],它和PbCO3受热都易分解成PbO.该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,假设一:全部为2PbCO3Pb(OH)2;
假设二:全部为PbCO3;
假设三:2PbCO3Pb(OH)2 和PbCO3的混合物
为验证假设一是否成立,课题组进行如下研究.
实验步骤 | 实验现象和结论 |
取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的洗气瓶. | 无水硫酸铜变蓝色,澄清石灰水变浑浊 |
①你是否同意该同学的结论,并简述理由 .
②如果不同意,请提出改进意见 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由锌、铁、铝、镁四种金属的两种组成的混合物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是( )
A. 锌 B. 铁 C. 铝 D. 镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com