
| 10.08L |
| 22.4L/mol |
| m |
| 160 |
| 48-m |
| 96 |
| 10.08L |
| 22.4L/mol |
| m |
| 160 |
| 48-m |
| 96 |
| 48g |
| 160g/mol |
| 19.2g |
| 160g/mol |
| 48g-19.2g |
| 96g/mol |


科目:高中化学 来源: 题型:
| A、“可燃冰”将有可能成为新能源 |
| B、“可燃冰”实质是水变成的固态油 |
| C、“可燃冰”使用方便,清洁卫生 |
| D、在海底和冻土层可能存在“可燃冰” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合物中含Na2CO3 0.1mol |
| B、原混合物中n(Na2CO3)+n(NaHCO3)=n(CaO) |
| C、30g固体中一定存在n(CaCO3)>n(NaOH) |
| D、不能确定原混合物中NaOH的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
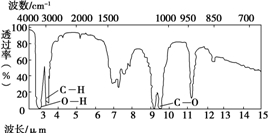 有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过足量的浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题:
有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过足量的浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com