
分析 (1)铝易被氧化,表面易形成致密的氧化膜;
(2)根据铝可以和氢氧化钠及水反应生成偏铝酸钠和氢气,气体压强增大;
(3)铁粉和水蒸气在高温条件下发生氧化还原反应生成四氧化三铁和氢气.
解答 解:(1)铝是一种比较活泼的金属,在常温下就很容易跟氧气发生反应,生成一层致密而坚固的氧化铝薄膜,
故答案为:铝表面容易生成一层致密的氧化物保护膜,对内部的金属起到了保护作用;
(2)根据铝可以和氢氧化钠及水反应生成偏铝酸钠和氢气,其化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,气体压强增大,易拉罐会慢慢复原,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)铁粉和水蒸气在高温条件下发生氧化还原反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
点评 本题主要考查了铝的性质及其化学方程式的书写,涉及氧化还原反应,根据反应物、生成物及反应条件书写方程式即可,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | MnS的Ksp比CuS的Ksp小 | |
| B. | 该反应达平衡时c(Mn2+)=c(Cu2+) | |
| C. | 设该反应的平衡常数为K,则该关系成立:K×Ksp(CuS)=Ksp(MnS) | |
| D. | 往平衡体系中加入少量CuSO4固体后,c(Cu2+)减小,c(Mn2+)变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁的硬度小于铝 | B. | 镁的熔、沸点低于钙 | ||
| C. | 镁的硬度大于钾 | D. | 钙的熔、沸点高于钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )| A. | 分子式为C20H24 | B. | 一氯代物的同分异构体只有两种 | ||
| C. | 分子中含有4个亚甲基(-CH2-) | D. | 分子中含有4个五元碳环 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
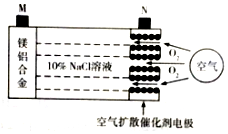 中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )
中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )| A. | 电池工作时,负极附近溶液的pH升高 | |
| B. | 电池工作时,电流由M极经外电路流向N极 | |
| C. | 电路中转移2mol电子,理论上约消耗标准状况下空气56L | |
| D. | 电池总反应为4Al+3O2=2Al2O3、2Mg+O2=2MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3 | B. | CH3CH(CH3)CH2CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol/L | B. | 0.03mol/L | C. | 0.3mol/L | D. | 0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t2~t3 | t4~t5 | t5~t6 |
| K1 | K2 | K3 |
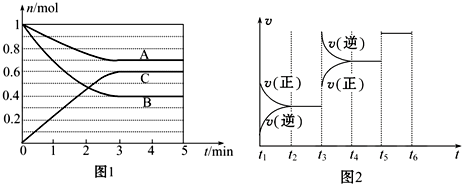
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com