
下列说法不正确的是
A.不含其他杂质的天然油脂属于纯净物
B.油脂在酸性或碱性溶液中都比在水中易水解
C.油脂的烃基部分饱和程度越大,熔点越高
D.各种油脂水解后的产物中都有甘油
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:推断题
物质M是一种日常生活中不可缺少的调味品。已知C在D中燃烧发生苍白色火焰,M与其他物质的转化关系如图甲所示(部分产物已略去);
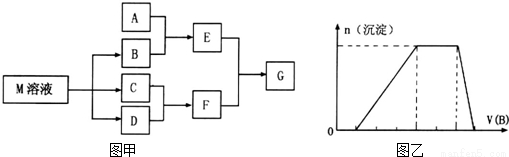
(1)写出用惰性电极电解M溶液的离子方程式___________________________________。
(2)比较B中各元素原子半径大小__________(填元素符号)。
(3)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是______________。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________________________。
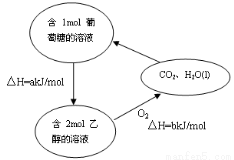
(5)若A是一种溶液,只可能含有H+,NH4+,Mg2+,Fe3+,Al3+,CO32-,SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图乙所示.由此可知,该溶液中肯定含有的离子及其浓度之比为___________________________。
(6)若E可用于检验葡萄糖的存在,写出G溶液充分蒸发灼烧后的产物与乙醇反应的化学方程式________。
(7)根据右图,写出25℃时由CO2和H2O转化为葡萄糖溶液的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
A.含有Y元素的可溶性盐溶于水一般都可以破坏水的电离平衡
B.Z的最高价氧化物能与水反应生成相应的酸
C.X、Y、Z原子半径由小到大的顺序是Y>Z>X
D.常温下,0.1 mol·L-1 W的气态氢化物的水溶液的pH>1
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:选择题
设某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,且X > 11将上述两溶液分别取等体积充分混合,混合液中各离子的浓度由大到小的顺序是( )
A.c(Cl-)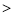 c(NH4+)
c(NH4+)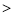 c(H+)
c(H+) c(OH-)
c(OH-)
B.c(NH4+) c(Cl-)
c(Cl-) c(H+)
c(H+) c(OH-)
c(OH-)
C.c(NH4+)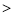 c(Cl-)
c(Cl-) 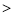 c(OH-)
c(OH-)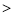 c(H+)
c(H+)
D.c(Cl-)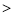 c(NH4+)
c(NH4+) c(OH-)
c(OH-) c(H+)
c(H+)
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期12月月考理综化学试卷(解析版) 题型:选择题
对下列装置图的叙述正确的是
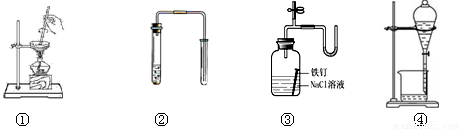
A.装置①可用于加热蒸干氯化铵溶液得到氯化铵晶体
B.装置②可用于铜和稀硝酸制取并收集少量NO
C.装置③可用于证明铁生锈氧气参与反应
D.苯萃取碘水中的碘后,从装置④下口放出的是碘的苯溶液
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第三次模拟化学试卷(解析版) 题型:实验题
氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
【查阅资料】
氢化钙通常用氢气与钙加热制得。
氢化钙要密封保存,遇水反应生成氢氧化钙和氢气。
钙遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热。
标准状况下氢气的密度为0.09g/L。
【进行实验】小组同学设计的制取装置如下图所示(固定装置略)。
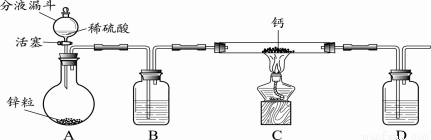
回答下列问题:
(1)写出A中发生反应的化学方程式 。
(2)B、D中所盛试剂相同,该试剂为 ,其作用分别是 、 。
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是 。
(4)装置C中制取氢化钙的化学方程式是 。
【实验反思】小组同学通过反思提出问题:上述制得的氢化钙是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量的氢化钙样品,按图所示连接仪器(固定装置略).
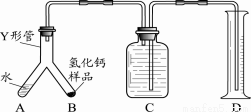
步骤2:将Y形管倾斜,使A中的水全部进入B中,完全反应后,冷却至室温,读取量筒读数.
通过上述实验可分析出制得的氢化钙是否纯净,其依据是______.
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第三次模拟考试理综化学试卷(解析版) 题型:填空题
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略).
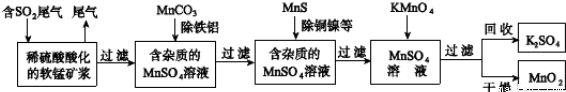
请回答下列问题:
(3)已知:25℃、101kPa时,
Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是____________________________________。
(2)用离子方程式表示用MnCO3除去Al3+和Fe3+的原理(任选其一即可):_______________。
(3)用离子方程式表示用MnS除去Cu2+和Ni2+的原理(任选其一即可):___________________________。
(4)MnO2是碱性锌锰电池的正极材料.碱性锌锰电池放电时,正极的电极反应式是__________。
(5)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是__________。
(6)假设脱硫的SO2只与软锰矿浆中MnO2反应.按照图示流程,将am3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为ckg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2____________kg。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期期中测试化学试卷(解析版) 题型:选择题
质量分数不等的两种硫酸溶液等质量混合时,其质量分数为a %,而等体积混合后的质量分数为b %;质量分数不等的两种氨水溶液等质量混合时,其质量分数为a %,,而等体积混合后的质量分数为c %。则a、b、c的大小关系正确的是: ( )
A.a>b>c B. b>a>c C. c>a>b D.a>c>b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com