
| A. | 100mL 0.5 mol•L-1MgCl2溶液 | B. | 100mL 0.5mol•L-1KClO3溶液 | ||
| C. | 200mL 0.25 mo l•L-1 KCl溶液 | D. | 200mL 0.5mol•L-1 HCl溶液 |
分析 根据离子的物质的量浓度=溶质的物质的量浓度×一个溶质电离出离子的个数,与溶液的体积无关.
解答 解:100mL0.5mol•L-1NaCl溶液中Cl-物质的量浓度为0.5mol•L-1×1=0.5mol•L-1
A、100mL 0.5 mol•L-1MgCl2溶液中Cl-物质的量浓度为0.5mol•L-1×2=1mol•L-1L,故A错误;
B、100mL 0.5mol•L-1KClO3溶液中不含Cl-,故B错误;
C、200mL 0.25 mo l•L-1 KCl溶液中Cl-物质的量浓度为0.25mol•L-1×1=0.25mol•L-1,故C错误;
D、100mL 0.5mol•L-1 HCl溶液中Cl-物质的量浓度为0.5mol•L-1×1=0.5mol•L-1,故D正确;
故选:D.
点评 本题考查离子浓度的计算,注意离子浓度与溶质浓度的关系即可解答,难度不大,注意与体积无关,选项B为易错点,KClO3溶液中 存在氯离子.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为五个椭圆交叉构成的图案,椭圆内分别写C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题:
如图为五个椭圆交叉构成的图案,椭圆内分别写C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n molO2 的同时,生成2n mol NO | |
| B. | 混合气体的密度不再改变 | |
| C. | 混合气体的平均相对分子质量不再改变 | |
| D. | 用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

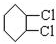 ,C
,C
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应②属于离子反应 | |
| B. | 若制取等量的Si3N4,则反应①②转移电子数目可能相等 | |
| C. | 反应①的氧化剂是SiO2 | |
| D. | 反应①中氧化产物与还原产物物质的量之比为6:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com