
| A、CaO+H2O═Ca(OH)2 | ||||
| B、2Na2O2+2H2O═4NaOH+O2↑ | ||||
| C、2Na+2H2O═2NaOH+H2↑ | ||||
D、C+H2O
|
科目:高中化学 来源: 题型:
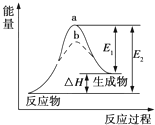
| A、该反应的反应热△H=E1-E2 |
| B、a、b分别对应有催化剂和无催化剂的能量变化 |
| C、催化剂能降低反应的活化能 |
| D、催化剂能改变反应的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述I | 陈述II |
| A | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
| B | NaHCO3溶于水完全电力 | NaHCO3是强电解质 |
| C | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| D | H2O2、SO2能使酸性KMnO4溶液褪色 | H2O2表现还原性,SO2表现漂白性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 |
| 平衡常数 | 9.94 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(D)=0.4 mol?L-1?s-1 |
| B、v(C)=0.5 mol?L-1?s-1 |
| C、v(B)=0.6 mol?L-1?s-1 |
| D、v(A)=0.15 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、C3N3(OH)3生成HNCO的反应为氧化还原反应 |
| B、生成1 mol N2转移的电子为6 mol |
| C、NO2在反应中被氧化为N2 |
| D、氧化产物与还原产物的物质的量之比为4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
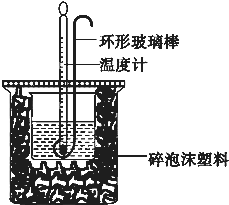 化学反应中的热效应
化学反应中的热效应| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性氧化物均可跟碱起反应 |
| B、酸性氧化物在常温常压下均为气态 |
| C、金属氧化物都是碱性氧化物 |
| D、不能跟酸反应的氧化物一定能跟碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com