分析:A、B、C、D、E五种物质均含有同一种元素,
(1)若A为单质,B、C均属于盐类,B的水溶液呈酸性,C的水溶液呈碱性,D是一种白色沉淀,A为金属单质,A为Al、B为强酸弱碱盐、C为NaAlO
2、D为Al(OH)
3、E为Al
2O
3,再结合题目解答;
(2)若A~E均为化合物.A是淡黄色固体,能发生反应生成B、C,则A是Na
2O
2,过氧化钠能和水、二氧化碳分别反应生成NaOH、Na
2CO
3,B、C两溶液在等物质的量浓度时,C 溶液的pH较小,则B是NaOH、C是Na
2CO
3,电解D的水溶液是最重要的工业生产之一,则D为NaCl,D→E→C也是工业制备C的普遍方法,则E是NaHCO
3;
(3)若A为单质,C、D的相对分子质量相差16,相差一个O原子,0.1mol/L E溶液中只有3种离子,且常温下溶液中的
=10
12,溶液呈强酸性,E为酸,符合条件时,A为N
2、B为NH
3、C为NO、D为NO
2、E为HNO
3,再结合物质之间的反应分析解答.
解答:
解:A、B、C、D、E五种物质均含有同一种元素,
(1)若A为单质,B、C均属于盐类,B的水溶液呈酸性,C的水溶液呈碱性,D是一种白色沉淀,A为金属单质,A为Al、B为强酸弱碱盐、C为NaAlO
2、D为Al(OH)
3、E为Al
2O
3,
①B为强酸弱碱盐,铝离子水解生成氢氧化铝和氢离子,导致溶液呈酸性,水解方程式为Al
3++3H
2O?Al(OH)
3+3H
+,故答案为:Al
3++3H
2O?Al(OH)
3+3H
+;
②C是偏铝酸钠,D是氢氧化铝,偏铝酸钠和酸反应生成氢氧化铝沉淀,离子方程式为AlO
2-+H
++H
2O=Al(OH)
3↓,故答案为:AlO
2-+H
++H
2O=Al(OH)
3↓;
③E是氧化铝、C是偏铝酸钠,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al
2O
3+2OH
-=2AlO
2-+H
2O,故答案为:Al
2O
3+2OH
-=2AlO
2-+H
2O;
(2)若A~E均为化合物.A是淡黄色固体,能发生反应生成B、C,则A是Na
2O
2,过氧化钠能和水、二氧化碳分别反应生成NaOH、Na
2CO
3,B、C两溶液在等物质的量浓度时,C 溶液的pH较小,则B是NaOH、C是Na
2CO
3,电解D的水溶液是最重要的工业生产之一,则D为NaCl,D→E→C也是工业制备C的普遍方法,则E是NaHCO
3;
①A是过氧化钠,其电子式为
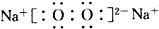
,故答案为:
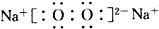
;
②用惰性电极电解氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,同时阴极附近生成氢氧根离子,离子方程式为2Cl
-+2H
2O
H
2↑+Cl
2↑+2OH
-,
故答案为:2Cl
-+2H
2O
H
2↑+Cl
2↑+2OH
-;
③生铁浸入D溶液而发生吸氧腐蚀,正极上氧气得电子和水生成氢氧根离子,电极反应式为O
2+4e
-+2H
2O=4OH
-,故答案为:O
2+4e
-+2H
2O=4OH
-;
(3)若A为单质,C、D的相对分子质量相差16,相差一个O原子,0.1mol/L E溶液中只有3种离子,且常温下溶液中的
=10
12,溶液呈强酸性,E为酸,符合条件时,A为N
2、B为NH
3、C为NO、D为NO
2、E为HNO
3①B是氨气、C是NO,氨气和氧气在催化剂、加热条件下生成NO和水,反应方程式为4NH
3+5O
24NO+6H
2O,故答案为:4NH
3+5O
24NO+6H
2O;
②A是氮气、C是NO,氮气和氧气的反应中,每转移1mol e
-就会吸热45kJ,则转移4mol电子吸收180kJ热量,所以该反应热化学反应方程式为N
2(g)+O
2(g)=2NO(g)△H=+180 kJ/mol,故答案为:N
2(g)+O
2(g)=2NO(g)△H=+180 kJ/mol.

 A、B、C、D、E五种物质均含有同一种元素,它们之间的转化关系如图所示:
A、B、C、D、E五种物质均含有同一种元素,它们之间的转化关系如图所示: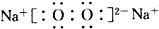 ,故答案为:
,故答案为: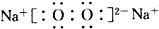 ;
;

 阅读快车系列答案
阅读快车系列答案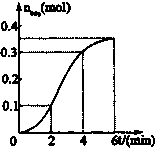 已知CaCO3与稀盐酸的反应为放热反应,取一定量的CaCO3与稀盐酸进行实验,生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
已知CaCO3与稀盐酸的反应为放热反应,取一定量的CaCO3与稀盐酸进行实验,生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )