

| A、液滴中的Cl-由a 区向b区迁移 |
| B、液滴边缘区发生的电极反应为:2H++2e-=H2 |
| C、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a 区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D、导致该现象的主要原因是液滴之下氧气含量比边缘处少. |


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、1molNH3所含有的原子数为NA |
| B、常温常压下,22.4L氧气所含的原子数为2NA |
| C、常温常压下,48gO3所含的氧原子数为3NA |
| D、标准状况下,33.6LH2O含有9.03×1023个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验食盐中含有钠离子,可以用焰色反应实验,如果焰色呈黄色则可以说明含有钠离子 |
| B、检验食盐中含有氯离子,则可以加用硝酸酸化的硝酸银溶液 |
| C、向溴水中加入食盐溶液,可以使溴水褪色 |
| D、食盐中加碘的作用是预防“大脖子病”的发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
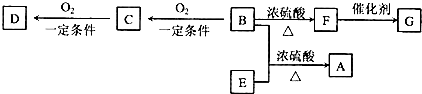
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 生理盐水,是指生理学实验或临床上常用的渗透压与动物或人体血浆的渗透压相等的氯化钠溶液.浓度:用于两栖类动物时是0.67~0.70%,用于哺乳类动物和人体时是0.85~0.9%人们平常点滴用的氯化钠注射液浓度是0.9%,可以当成生理盐水来使用.请回答下面有关点滴用的氯化钠注射液的问题.
生理盐水,是指生理学实验或临床上常用的渗透压与动物或人体血浆的渗透压相等的氯化钠溶液.浓度:用于两栖类动物时是0.67~0.70%,用于哺乳类动物和人体时是0.85~0.9%人们平常点滴用的氯化钠注射液浓度是0.9%,可以当成生理盐水来使用.请回答下面有关点滴用的氯化钠注射液的问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 2.向新制的H2S饱和溶液中滴加氯水 3.钠与滴有酚酞试液的冷水反应 4.镁带与2mol/L的盐酸反应 5.铝条与2mol/L的盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生大量气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成白色絮状沉淀,继而沉淀消失 F.生成淡黄色沉淀 |
| 实验方案 | 实验现象 | 有关离子方程式 |
| A | ||
| B | 不 填 | |
| C | 不 填 | |
| D | 不 填 | |
| E | ||
| F |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、以O2浓度变化表示的反应速率为0.064 mol?(L?s)-1 | ||
| B、反应达到平衡状态时NH3的转化率为20% | ||
C、升高温度能使
| ||
| D、将容器的体积变为4 L,平衡时NO的浓度小于0.4 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com