
| 温度℃) | 20 | 40 | 60 | 100 |
| 溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 化学式 | H2CO3 | CH3COOH |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
分析 (1)CaCO3与硫酸反应生成二氧化碳、硫酸钙和水,反应生成气体,容易产生大量泡沫使物料从反应器中溢出;
(2)加适量H2O2把Fe2+氧化为Fe3+,加MgO调节PH,使Fe3+、Al3+转化为沉淀;
(3)H3BO3的溶解度随温度的升高而增大,热过滤以防温度下降时H3BO3从溶液中析出;
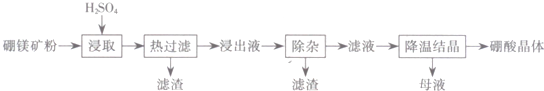
(4)根据图和溶液的沸点随压强增大而升高分析;
(5)根据硼酸的电离平衡常数可知,c(H+)=$\sqrt{K•c({H}_{3}B{O}_{3})}$;
(6)相同温度、浓度下,酸的电离平衡常数越大,酸的酸性越强,其酸根离子的水解能力越小,结合强酸制取弱酸分析解答.
解答 解:(1)CaCO3与硫酸反应生成二氧化碳、硫酸钙和水,该反应的化学方程式为:CaCO3 (粉末)+H2SO4=CaSO4+H2O+CO2↑,由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,故应分批加入H2SO4;
故答案为:应分批加入H2SO4 ;
(2)加适量H2O2把Fe2+氧化为Fe3+,所以H2O2的作用是:H2O2+2H++2Fe2+=2Fe3++2H2O,加MgO调节PH,使Fe3+、Al3+转化为沉淀而除去,所以除去的离子有Fe3+、Fe2+、Al3+;
故答案为:Fe3+、Fe2+、Al3+;H2O2+2H++2Fe2+=2Fe3++2H2O;
(3)有题目信息可知:H3BO3的溶解度随温度的升高而增大,所以要采用“热过滤”,以防温度下降时H3BO3从溶液中析出;
故答案为:防止温度下降时H3BO3从溶液中析出;
(4)根据图可知温度越高MgSO4•H2O的溶解度越小,由于溶液的沸点随压强增大而升高,为了防止溶液沸腾,应该在较高的压强条件下加热,使MgSO4•H2O结晶析出,
故答案为:加压升温结晶;
(5)25℃时0.7mol•L-1 硼酸溶液中H+的浓度:c(H+)=$\sqrt{K•c({H}_{3}B{O}_{3})}$=$\sqrt{5.7×1{0}^{-10}×0.7}$mol/L≈2×10-5mol•L-1,故答案为:2×10-5mol•L-1;
(6)相同温度、浓度下,酸的电离平衡常数越大,酸的酸性越强,其酸根离子的水解能力越小,根据电离平衡常数知,酸性强弱顺序是CH3COOH>H2CO3>H3BO3>HCO3-,所以离子水解能力碳酸根离子>碳酸氢根离子>醋酸根离子,
A.酸性H2CO3>H3BO3>HCO3-,所以碳酸钠溶液滴入硼酸中生成碳酸氢钠和硼酸钠,没有气体生成,故A错误;
B.酸性CH3COOH>H2CO3,所以碳酸钠溶液滴入醋酸中生成醋酸钠、水和二氧化碳,所以能看到有气泡生成,故B正确;
C.酸性H2CO3>H3BO3,所以碳酸的电离程度大于硼酸,则等浓度的碳酸和硼酸溶液比较,碳酸的酸性大于硼酸,所以pH:前者<后者,故错误;
D.酸性CH3COOH>H2CO3,所以碳酸根离子水解能力大于醋酸根离子,则等浓度的碳酸钠和醋酸钠溶液比较,pH:前者>后者,故D正确;
故答案为:BD.
点评 本题考查了物质的分离提纯,涉及化学方程式的书写,除杂方法和试剂的选择,以及图象的分析等,题目难度较大,注意对图象的分析和对题干信息的分析.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
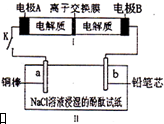 如图所示装置是一种可充电电池,装置II为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
如图所示装置是一种可充电电池,装置II为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )| A. | 负极反应为2S22--2e-=S42- | |
| B. | 当有0.01 mol Na+通过离子交换膜时,b电极上析出气体112 mL | |
| C. | 闭合K后,b电极附近的pH变小 | |
| D. | 闭合K后,a电极上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L Na2SO3溶液中c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) | |
| B. | 0.1 mol•L-1 NaHCO3溶液中;c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 对滴有酚酞的CH3COONa溶液进行加热,溶液颜色会加深 | |
| D. | 在pH=5.6的CH3COOH与CH3COONa的混合溶液中:c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | G | |
| 最低化合价 | -4 | -2 | -1 | -2 | -1 | -3 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 | 3.0 |
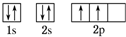 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化银的浊液中加入氯化钠溶液,氯化银的溶解度减小 | |
| B. | 向2.0×10-1mol/L的K2CrO4溶液中加入等体积的2.0×10-1mol/LAgNO3溶液,则有Ag2CrO4沉淀生成 | |
| C. | 将一定量的AgCl和Ag2CrO4固体棍合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大 | |
| D. | 将0.001 mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001 mol/L的K2CrO4溶液,则先产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=3.6mol/(L•s) | B. | v(B)=0.075mol/(L•s) | C. | v(C)=0.030mol/(L•s) | D. | v(D)=0.060mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>2 | B. | X=2 | C. | 2>X>1 | D. | X=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com