
 常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )
常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )| A. | 若a点pH=4,且c(Cl-)=m c(ClO-),则Ka(HClO)=$\frac{1{0}^{-4}}{m+1}$ | |
| B. | 若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH | |
| C. | 若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO) | |
| D. | b~c段,随NaOH溶液的滴入,$\frac{c(HClO)}{c(Cl{O}^{-})}$逐渐增大 |
分析 整个过程先后发生的反应为Cl2+H2O?HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,
A.若a点pH=4,c(H+)=10-4mol/L,溶液呈酸性,根据氯守恒可知:c(H+)=c(Cl-)+c(ClO-)=10-4 mol/L,且c(Cl-)=mc(ClO-),则c(ClO-)=$\frac{1{0}^{-4}}{m+1}$mol/L,结合Ka(HClO)=$\frac{c({H}^{+})c(Cl{O}^{-})}{c(HClO)}$来解答;
B.若x=100,Cl2恰好与NaOH溶液生成NaCl、NaClO,NaClO水解生成次氯酸,次氯酸具有漂白性,不能用pH试纸测pH;
C.若y=200,c点对应溶液中存在0.1molNaCl、0.1molNaClO、0.1molNaOH,根据电荷守恒与物料守恒来解答;
D.b~c段,Cl2恰好与NaOH溶液生成NaCl、NaClO,随NaOH溶液的滴入,NaOH抑制NaClO水解:ClO-+H2O?HClO+OH;
解答 解:A.若a点pH=4,c(H+)=10-4mol/L,溶液呈酸性,根据氯守恒可知:c(H+)=c(Cl-)+c(ClO-)=10-4mol/L,且c(Cl-)=mc(ClO-),则c(ClO-)=$\frac{1{0}^{-4}}{m+1}$mol/L,所以Ka(HClO)=$\frac{c({H}^{+})c(Cl{O}^{-})}{c(HClO)}$=$\frac{1{0}^{-4}mol/L×\frac{1{0}^{-4}}{m+1}mol/L}{(1{0}^{-4}-\frac{1{0}^{-4}}{m+1})mol/L}$=$\frac{1{0}^{-4}}{m}$,故A错误;
B.若x=100,Cl2恰好与NaOH溶液生成NaCl、NaClO,NaClO水解生成次氯酸,次氯酸具有漂白性,不能用pH试纸测pH,应选pH计,故B错误;
C.若y=200,c点对应溶液中存在0.1molNaCl、0.1molNaClO、0.2molNaOH,根据电荷守恒得:c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-)①,
氯元素守恒得:c(Cl-)=c(ClO-)+c(HClO) ②,2c(Cl-)+2c(ClO-)+2c(HClO)=c(Na+)③,由①+③+②得:c(OH-)=2c(Cl-)+c(HClO)+c(H+),故C正确;
D.b~c段,Cl2恰好与NaOH溶液生成NaCl、NaClO,随NaOH溶液的滴入,NaOH抑制NaClO水解:ClO-+H2O?HClO+OH,c(HClO)减小,c(ClO-)增大,所以$\frac{c(HClO)}{c(Cl{O}^{-})}$减小,故D错误;
故选C.
点评 本题考查了离子浓度大小的判断,题目难度中等,明确溶液中的溶质及其性质是解本题关键,注意电荷守恒、物料守恒及盐的水解原理的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2CO3和1mol NaOH | B. | 1mol Na2CO3和2mol NaOH | ||
| C. | 2mol Na2CO3和2mol NaOH | D. | 2mol Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制2.0 mol•L-1的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为950 mL和201.4 g | |
| B. | 标准状况下,用3.36L HCl气体做喷泉实验完毕后,液体冲入烧瓶的一半(假设实验过程溶液无泄漏),溶液中溶质的物质的量浓度为$\frac{1}{22.4}$mol/L | |
| C. | 向0.1mol•L-1 CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| D. | 将溶质相同质量分数分别为3p%的溶液和p%的溶液等体积混合得到质量分数为q%的溶液,则p、q的关系不可能为q>2p |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子组 | 加入试剂 | 离子方程式 | |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | SO42-+2NH4++Ba2++2OH-=BaSO4↓+2NH3•5H2O |
| B | Mg2+、HCO3-、Cl-、 | 过量NaOH溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe3+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
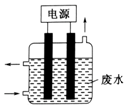 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com