
| A. | 陶瓷的主要成分属于硅酸盐 | |
| B. | 青铜的熔点比组份金属铜和锡都高 | |
| C. | 利用SO2漂白纸张时只发生了物理变化 | |
| D. | 黑火药反应2KNO3+S+3C=K2S+N2↑+3CO2↑中,氧化剂只有KNO3 |
分析 A.在无机非金属材料中,硅及其化合物是密切联系生产生活的一类重要物质,陶瓷、玻璃、水泥等都是硅酸盐产品;
B.青铜为铜的合金,熔点比组份都低;
C.SO2漂白纸张属于化合漂白,发生化学变化;
D.含元素化合价降低的物质为氧化剂.
解答 解:A.陶瓷是用泥土烧纸而来,泥土的主要成分为硅酸盐,故A正确;
B.青铜为铜的合金,熔点比组份都低,所以青铜的熔点比组份金属铜和锡都低,故B错误;
C.SO2漂白纸张属于化合漂白,加热又恢复原来的颜色,发生化学变化,故C错误;
D.黑火药反应2KNO3+S+3C=K2S+N2↑+3CO2↑中,S、N元素的化合价降低,所以氧化剂有KNO3和S,故D错误;
故选A.
点评 本题考查了SO2漂白原理、氧还原反应中氧化剂的判断、合金的性质,熟悉相关物质的性质是解题关键,题目难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液与石灰乳的反应:CO32-+Ca 2+=CaCO3↓ | |
| B. | 硝酸银溶液与食盐水的反:Ag++Cl-=AgCl↓ | |
| C. | 锌与盐酸的反应:Zn+2H++2Cl -=Zn 2++2Cl-+H2↑ | |
| D. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe 3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红的溶液中:Na+、Cl-、CH3 COO-、Fe2+ | |
| B. | 加铝粉能产生大量H2的溶液中:Na+、NH4+、NO3-、Cl- | |
| C. | 无色溶液中:Al3+、NO3-、Cl-、SO42- | |
| D. | c(FeCl3)=1.0mol/L的溶液中:HCO3-、Cl-、H+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
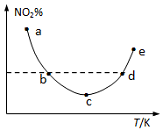 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g).反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g).反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.据图分析,下列说法正确的是( )| A. | 图中a、b两点对应的反应未达到平衡状态 | |
| B. | 图中b、d两点对应的NO2速率相等 | |
| C. | 该反应为吸热反应 | |
| D. | e点对应的容器中气体颜色最深 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
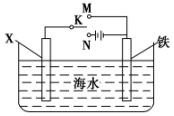 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、Y、R的简单离子半径依次增大 | |
| B. | X、R、Z都可与Y形成两种化合物 | |
| C. | X2Y的热稳定性强于X2R、沸点也高于X2R,但解释的理由不相同 | |
| D. | Z元素分别与X元素和Y元素形成的化合物都是离子晶体,均能与水反应且一定生成了强碱和无色气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com