
【题目】我国工业制硫酸主要反应有(均为放热反应):①4FeS2+11O2![]() 8SO2+2Fe2O3,②2SO2+O2
8SO2+2Fe2O3,②2SO2+O2 ![]() 2SO3,③SO3+H2O=H2SO4。回答下列问题:
2SO3,③SO3+H2O=H2SO4。回答下列问题:
(1)为了提高反应①硫铁矿的利用率,可采取的措施有____________________。工业上也可以使用硫作为制取硫酸的方法,1g硫粉在氧气中充分燃烧放出9.36 kJ热量,写出硫燃烧的热化学方程式__________________________。
(2)反应②中SO2的平衡转化率(α)与某条件的关系如下图所示,其中正确的是________。



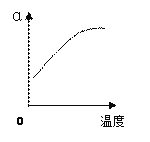
A B C D
(3)500oC和1.01×105Pa时将4.0 mol SO2和2.0 mol O2置于2L密闭容器中,反应达平衡时c(O2)=0.1 mol/L,则该反应的平衡常数等于_______,若将温度降到400oC,该反应的化学平衡常数__________(增大、减小或不变)。
(4)反应③得到“发烟硫酸”,往往稀释成98%的浓硫酸再出售。若分别用98%的浓硫酸、10%的稀硝酸、10%的稀醋酸分别与等量的NaOH溶液进行中和热的测定实验,三个反应的反应热依次为△H1、△H2、△H3,则它们的大小关系是____________________________。
【答案】 将矿石粉碎或鼓入稍过量的空气 S(s)+O2(g)==SO2(g)△H=-299.52kJ/mol BC 810 L/mol 增大 △H1<△H2<△H3
【解析】试题分析:(1)根据影响反应速率的因素分析。硫燃烧生成二氧化硫,1g硫粉在氧气中充分燃烧放出9.36 kJ热量,则1mol硫燃烧放热299.52kJ;(2)根据影响平衡移动的因素分析SO2的转化率的变化;(3)利用“三段式”计算平衡常数,正反应放热,升高温度平衡逆向移动;(4)浓硫酸溶于水时放热,使其放出的总热量增多;醋酸是弱酸,只有少部分电离,电离过程中要吸热,故中和时放热较少;
解析:(1)将矿石粉碎可以增大与氧气的接触面积,加快反应速率;鼓入稍过量的空气氧气浓度增大,反应速率加快,所以为了提高反应①硫铁矿的利用率,可采取的措施有将矿石粉碎或鼓入稍过量的空气。硫燃烧生成二氧化硫,1g硫粉在氧气中充分燃烧放出9.36 kJ热量,则1mol硫燃烧放热299.52kJ,所以硫燃烧的热化学方程式是S(s)+O2(g)==SO2(g)△H=-299.52kJ/mol;(2)加入催化剂平衡不移动,SO2的平衡转化率不变,故A错误;增大氧气的比例,平衡正向移动,SO2的平衡转化率增大,故B正确;增大压强平衡正向移动,SO2的平衡转化率增大,故C正确;升高温度平衡逆向移动,SO2的平衡转化率减小,故D错误;
(3)
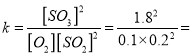 810 L/mol;
810 L/mol;
,正反应放热,降低温度平衡正向移动,平衡常数增大;(4)浓硫酸溶于水时放热,使其放出的总热量增多;醋酸是弱酸,只有少部分电离,电离过程中要吸热,故中和时放热较少;若分别用98%的浓硫酸、10%的稀硝酸、10%的稀醋酸分别与等量的NaOH溶液进行中和热的测定实验,三个反应的反应热依次为△H1、△H2、△H3,则它们的大小关系是△H1<△H2<△H3。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】海洋是生命的摇篮,有关海洋中部分资源的利用如图所示,回答下列问题 
(1)操作①是 , 操作②使用的主要玻璃仪器是;
(2)含I﹣溶液中加入试剂X的目的是将I﹣(填“氧化”或“还原”)成I2;试剂Y选择原则包括:与碘不反应、碘在Y中的溶解度大于在水中的溶解度和;
(3)为除去粗盐中含有硫酸钠、氯化镁、氯化钙等杂质,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质,将杂质转化为沉淀过滤除去,再向滤液中加入适量盐酸得到精盐水.该工程示意如下: 
以下叙述正确的是(双选)
A.①操作中需要进行搅拌,目的是提高氯化钠的溶解度
B.③、④两步操作顺序可以颠倒
C.⑤操作得的沉淀中共有三种物质
D.⑥操作中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7
(4)海水资源也可以提炼出铝,铝制品与铁制品相比,在空气中不易锈蚀,原因是:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量w和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的质量之比为( ) 
A.2:3
B.1:1
C.4:3
D.8:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,由加成反应引起的是
A. 乙烯通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色
B. 含碳原子较多的烷烃加热、加压、催化剂条件下反应生成含碳原子较少的烷烃和烯烃
C. 在光照条件下,C2H6与Cl2反应生成了油状液体
D. 在催化剂作用下, 乙烯与水反应生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现应用酸碱中和滴定法测定某市售白醋的含酸量.
Ⅰ.实验步骤
(1)用___________(填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_________作指示剂.
(3)读取盛装0.1000 molL﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如右图所示,则此时的读数为_______mL.
![]()
(4)滴定.滴定过程中,眼睛应注视__________________________; 当滴至____________________________________时停止滴定,并记录NaOH溶液的终读数.重复滴定4次.
Ⅱ.实验记录
实验序号 | 待测白醋溶液体积/mL | 0.1000mol·L-1 NaOH溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 0.10 | 15.10 |
2 | 20.00 | 0.00 | 14.95 |
3 | 20.00 | 0.15 | 15.20 |
4 | 20.00 | 1.10 | 17.10 |
Ⅲ.数据处理与讨论
(1)按实验所得数据,可折算得c(市售白醋)=________molL-1.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是___填写序号)
a.碱式滴定管在装液前未用标准NaOH溶液润洗.
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失.
c.锥形瓶中加入待测白醋溶液后,再加少量水.
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是
A.Al3+、NO3―、K+、SO42ˉ B.Ca2+、H+、CO32ˉ、AlO2―
C.OHˉ、SO42ˉ、NH4+、Al3+ D.Fe3+、Mg2+、NO3ˉ、Clˉ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com