
【题目】如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuSO4溶液。
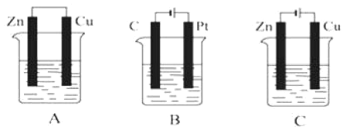
(1)A、B、C三个装置中属于原电池的是___(填字母,下同),属于电解池的是___。
(2)A池中Cu电极上发生的是___(填“氧化”或“还原”)反应。
(3)B池中C是___极,Pt极发生的反应的电极反应式为___。
(4)C池反应过程中,CuSO4溶液的物质的量浓度___(填“变大”“变小”或“不变”)
【答案】A BC 还原 阴 4OH--4e-=2H2O+O2↑ 不变
【解析】
(1)根据装置图判断原电池和电解池;
(2)A池为原电池,硫酸铜溶液为电解质溶液,则活泼金属作负极,即Zn为负极,失去电子,发生氧化反应;Cu作正极,发生还原反应;
(3)B池为电解池,与电源正极连接的是阳极,原电源负极相连接的是阴极,因此Pt为阳极,C为阴极,阳极上OH-失去电子发生氧化反应,阴极上Cu2+得到电子发生还原反应;
(4)C池为电解池,阳极是铜,阴极是锌,阳极上Cu-2e-=Cu2+,阴极上Cu2++2e-=Cu。
(1)由装置图可知A装置为原电池,B和C装置为电解池;
(2)A池中Cu作正极,发生还原反应;
(3)B池为电解池,其中Pt为阳极,C为阴极,阳极上OH-失去电子发生氧化反应,电极反应为:4OH--4e-=2H20+O2↑;
(4)C池为电解池,阳极是铜,阴极是锌,阳极上Cu-2e-=Cu2+,阴极上Cu2++2e-=Cu,阴极上析出的铜与阳极上溶解得铜相等,因此CuSO4溶液的物质的量浓度不变。
原电池 | 电解池 | |
定义 | 将化学能转变成电能的装置 | 将电能转变成化学能的装置 |
形成 条件 | ①活泼性不同的两电极(连接) ②电解质溶液(电极插入其中并与电解质溶液或其中溶解的其他物质自发反应) ③形成闭合回路 ④自发的氧化还原反应 | ①两电极分别接直流电源的正、负极 ②两电极插入电解质溶液 ③形成闭合回路 |
电极 名称 | 负极:较活泼金属 正极:较不活泼金属(或能导电的非金属) | 阳极:与电源正极相连的极 阴极:与电源负极相连的极 |
电极 反应 | 负极:金属失电子,发生氧化反应 正极:溶液中的阳离子得电子,发生还原反应 | 阳极:氧化反应、溶液中的阴离子失电子或电极金属失电子 阴极:还原反应,溶液中的阳离子得电子 |
电子 流向 | 负极 | 电源负极 电源正极 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活和社会密切相关。下列有关说法不正确的是![]()
A.发展“低碳经济”能够减少对化石能源的依赖
B.明矾溶于水会生成氢氧化铝胶体,故可用明矾作净水剂
C.铁制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀
D.处理含![]() 的废水,常用FeS作沉淀剂,是因为CuS的溶解度比FeS小
的废水,常用FeS作沉淀剂,是因为CuS的溶解度比FeS小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀。下列说法正确的是

A.阴极的电极反应式为4OH--4e-=O2↑+2H2OB.阳极的电极反应式为Zn-2e-=Zn2+
C.通电时,该装置为牺牲阳极的阴极保护法D.断电时,锌环失去保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.其它条件不变时,增大反应物浓度能使活化分子百分数提高,反应速率加快
B.反应物总能量高于生成物总能量的反应,一定能自发进行
C.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
D.因为催化剂能改变反应活化能,所以能影响化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 合成氨反应放热,采用低温可以提高氨的生成速率
B. 常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低
C. 反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0
D. 在一容积可变的密闭容器中反应2SO2(g)+O2(g)![]() 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,
2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
① I2(g)+ H2(g)![]() 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
② I2(s)+ H2(g)![]() 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应②的反应物总能量比反应①的反应物总能量低
D.反应①的产物比反应②的产物稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验的描述不正确的是( )
A.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏低
B.过滤时,玻璃棒靠在三层滤纸边沿稍下方
C.在镀件上电镀铜时,可用金属铜作阳极
D.在用Fe(OH)3胶体溶液做电泳实验时,阴极区红色加深,可知Fe(OH)3胶体粒子带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①![]() △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
H-H | N-H | N≡N |
436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n(![]() )/n(
)/n(![]() )]时反应达到平衡时
)]时反应达到平衡时![]() 的转化率变化曲线。
的转化率变化曲线。
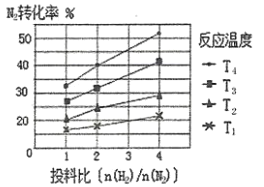
①![]() 、
、![]() 、
、![]() 、
、![]() 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n(![]() )/n(
)/n(![]() )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A.![]() 的浓度增大
的浓度增大
B.![]() 的转化率增大
的转化率增大
C.![]() 的体积分数增大
的体积分数增大
D.![]() 的浓度减小
的浓度减小
③温度为![]() 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v(![]() )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在![]() 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用![]() 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出![]() 还原
还原![]() 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是
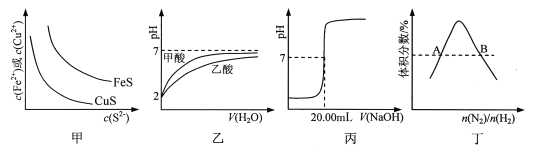
A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com