
【题目】化学与人类生活、生产和社会可持续发展密切相关,下列有关说法或操作不正确的是( )
①为增强消毒液(有效成分NaClO)的消毒能力,可以滴加几滴浓盐酸
②新冠病毒可以采用高温或酒精来杀死,均利用的是蛋白质的变性
③常见的化学键有离子键、共价键、氢键
④石油的蒸馏、分馏、精馏是物理变化,而煤的干馏是化学变化
⑤硅酸钠俗称水玻璃
⑥苯在工业上,既可以以煤为原料制备,也可以以石油为原料制备
A.①②⑥B.①③⑤C.③⑤⑥D.①④⑥
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Ni、Fe、Al2O3、CaO、炭及有机物等)制取CoC2O4的工艺流程如下:
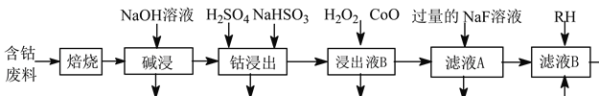
己知:①草酸钴晶体难溶于水
②RH为有机物,可用RH、有机溶剂萃取出溶液中的Ni2+
③几种金属阳离子的氢氧化物沉淀时的PH如表所示:
Fe3+ | Co2+ | |
开始沉淀时 | 1.9 | 7.1 |
沉淀完全时 | 3.7 | 9.1 |
(1)“焙烧”的目的_______。
(2)“碱浸”过程中Al2O3发生反应的化学方程式为_______。
(3) 经硫酸酸化后,“钴浸出”过程中Co3+转化为Co2+的离子方程式为_______。
(4)“浸出液B”中加入CoO并调节pH值至3.7~7.1的目的为_______。
(5) 加入NaF溶液可将钙离子转化为沉淀并过滤除去,若所得滤液中c(F-)=1.0×10-2mol·L1,则滤液中c(Ca2+)为_______mol·L1[已知Ksp(CaF2)=1.05×10-10]。
(6) 萃取后水层中含有大量的Co2+,将水层与酸性KMnO4溶液充分混合生成Co3+、Mn2+,理论上完全反应消耗的n(Co2+)∶n(MnO4-)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的用途及反应方程式的叙述不正确的是( )
A.印刷电路板时用FeCl3作为腐蚀液:2Fe3+ + Cu == 2Fe2+ + Cu2+
B.用HF雕刻玻璃:SiO2 + 4HF == SiF4↑ + 2H2O
C.高炉炼铁的主要原理:CO + FeO == Fe + CO2
D.小苏打做发酵粉:2NaHCO3 == Na2CO3 + H2O + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业冶炼铜的原料,主要成分为CuFeS2。试回答下列问题:
(1)基态Cu原子的核外电子排布式为________;Cu、Zn的第二电离能大小I2(Cu)________(填“>”“<”或“=”)I2(Zn)。
(2)SO2分子中分子空间构型为________;与SO2互为等电子体的阴离子有________(写一种)。
(3)[Cr(H2O)4Br2]Br·2H2O中心离子配位数为_______
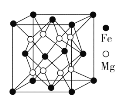
(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。晶胞距离Mg原子最近Mg数目为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成一种增强记忆力药物的重要中间体,其合成路线如下:
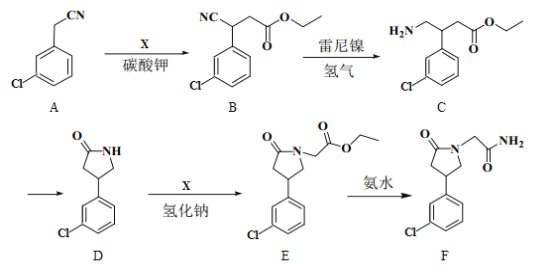
(1)E中的含氧官能团名称为__________。(写一种)
(2)A→B的反应类型为__________。
(3)写出同时满足下列条件的B的一种同分异构体的结构简式:__________。
①为α-氨基酸;②苯环上有4个取代基;③有6种不同化学环境的氢。
(4)C转为D生成的另一种产物的结构简式为__________。
(5)已知:R—Br→R—CN,请写出以苯甲醇(![]() )和
)和![]() 为原料制备有机物X
为原料制备有机物X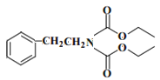 (结构如图)的合成路线流程图__________________(无机试剂任用,合成路线流程图示例见本题题干)。
(结构如图)的合成路线流程图__________________(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环扁桃酯具有松弛血管平滑肌,扩张血管的功能,其一种同系物(X)可以发生如下转化,下列说法中错误的是( )
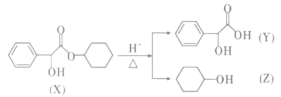
A.X的分子式为C14H18O3
B.Y可以发生氧化反应、还原反应、酯化反应、缩聚反应
C.Y中最多可以有15个原子共平面
D.Z的同分异构体含有醛基(一CHO)有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)![]() 2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为______。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______.
A.消耗1molN2同时生成1molO2![]() 混合气体密度不变
混合气体密度不变
C.混合气体平均相对分子质量不变D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态![]() 与原平衡状态相比,此时平衡混合气中NO的体积分数______
与原平衡状态相比,此时平衡混合气中NO的体积分数______![]() 填“变大”、“变小”或“不变”
填“变大”、“变小”或“不变”![]()
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中放出的热量为______kJ。
(2)肼(N2H4)-空气燃料电池(产物为N2和H2O)是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:_______,负极的电极反应式:_______。
(3)如图是一个电解过程示意图。
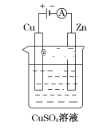
①锌片上发生的电极反应式是:____________
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气______L.(假设空气中氧气体积分数为20%;Cu相对原子质量:64)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com