
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
分析 (1)物质的熔点与晶体类型有关,原子晶体的熔点大于分子晶体的熔点;如果晶体类型相同,物质的熔点与化学键的键长成反比,键长越短,键能越大,熔点越高;
(2)晶体熔点与晶体类型有关,原子晶体中的作用力是共价键,分子晶体中的作用力是范德华力,共价键比范德华力大很多,导致异响其熔点;
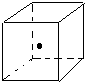
(3)金刚石中每个碳原子和四个碳原子形成四个共价键,如果一个碳原子在正方体体心上,4个碳原子在相对的4个顶点上;
(4)化学反应方程式中的反应热=反应物的键能之和-生成物的键能之和.
解答 解:(1)碳化硅和硅都是原子晶体,晶体类型相同的物质其熔点与键长成正比,键长越长,键能越小,熔点越低,碳化硅的键长小于硅硅键长,所以碳化硅的熔点比硅的高;二氧化硅是原子晶体,氯化硅是分子晶体,原子晶体的熔点高于分子晶体,所以二氧化硅的熔点比氯化硅的高,
故答案为:>;<;
(2)物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低,
故答案为:不能;物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低;
(3)金刚石中每个碳原子和四个碳原子形成四个共价键,如果一个碳原子在正方体体心上,4个碳原子在相对的4个顶点上,所以为: ,故答案为:
,故答案为: ;
;
(4)△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol,故答案为:+236 kJ/mol.
点评 本题考查了熔点大小的判断、反应热的计算等知识点,注意反应热中硅的键能,在硅晶体中每个硅原子和其它4个硅原子形成4个共价键,所以每个硅原子含有2个共价键,此点为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 正极 | 负极 | 电解质溶液 | |
| A | Cu | Zn | HCl |
| B | Zn | Cu | CuSO4 |
| C | Cu | Zn | CuCl2 |
| D | Zn | Cu | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 电能是现代社会应用最广泛的能源之一.原电池是一种将化学能转化为电能的装置.如图所示的锌、铜和稀硫酸组成的原电池中,锌片上发生氧化反应(填“氧化”或“还原”).铜片上的电极反应式是2H++2e-=H2↑.能否根据反应NaOH+HCl=NaCl+H2O 设计成原电池,否(填“能”或“否”),原因是该反应不是氧化还原反应,没有电子转移.
电能是现代社会应用最广泛的能源之一.原电池是一种将化学能转化为电能的装置.如图所示的锌、铜和稀硫酸组成的原电池中,锌片上发生氧化反应(填“氧化”或“还原”).铜片上的电极反应式是2H++2e-=H2↑.能否根据反应NaOH+HCl=NaCl+H2O 设计成原电池,否(填“能”或“否”),原因是该反应不是氧化还原反应,没有电子转移.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 CH3COOCH2CH2OOCCH3+2H2O.
CH3COOCH2CH2OOCCH3+2H2O.
 、
、 ;.
;.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中KNO3是氧化剂,N2是还原产物 | |
| B. | 每生成16 mol N2转移30 mol电子 | |
| C. | 若氧化产物比还原产物多1.75mol,则转移电子的物质的量为1.25mol | |
| D. | 该反应中氧化产物与还原产物的质量之比为1:15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com